
您是否曾经想测量您感兴趣的蛋白质在单个细胞中的表达?或者,您可能需要分析复杂群体中的特定细胞子集。您是否在生物安全柜中使用克隆环或遵循劳动密集型限制稀释方案花费数小时?如果这听起来像您,那么流式细胞术可以帮助您克服这些挑战,并使这些类型的实验更容易和更快地进行。
流式细胞仪简介
流式细胞术允许用户分析群体中的单个细胞。单个细胞通过激光路径并使用各种可见和荧光光源进行询问,使用户能够评估细胞的大小、粒度和目标蛋白质组成。它可用于多种应用,例如测量靶蛋白表达水平、评估翻译后修饰、确定细胞健康、分析细胞周期阶段以及检测复杂组织或样品中的特定细胞群 ( 1 )。当与细胞分选仪结合使用时,该技术可用于在称为荧光激活细胞分选或 FACS ( 2)。通过分析单个细胞而不是整个群体,科学家们在观察中获得了统计能力。然而,虽然流式细胞仪提供细胞水平的分析,但它不能用于亚细胞分析,例如形态学或亚细胞定位研究。对于这些,必须使用荧光显微镜等替代方法。要了解有关最适合您研究的荧光显微镜技术的更多信息,请参阅 Addgene 的博客文章哪种荧光显微镜技术最适合我?
仪器概述
流式细胞仪结合了三个系统来分析混合物中的单个细胞 ( 3 ):
光学系统
流体系统
电子系统
首先将细胞重新悬浮在称为鞘液的加压缓冲液中,并通过管或毛细管输送到激光器。当细胞通过流体系统时,它们会通过一个流动池,该流动池限制了液流的大小,并在称为流体动力学聚焦的过程中迫使细胞排成一行。这允许每个细胞以单行的方式通过激光路径,并被光学系统询问(图 1)。
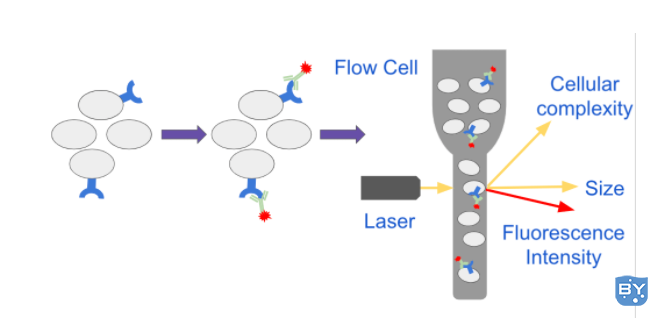
图 1:表达特定表面受体的细胞用针对受体的荧光抗体染色,并在流式细胞仪上进行分析。当细胞通过流通池时,样品流的大小会减小,从而迫使细胞排成一个文件。单个细胞通过激光路径,仪器收集有关细胞大小、复杂性和荧光强度的信息。
流式细胞仪检测什么
细胞大小和复杂性,使用可见光散射测量
光学系统具有可见光源和荧光光源。可见光照亮每个细胞,因为它通过并在不同方向散射。散射程度由检测器捕获,并提供有关细胞的有用信息。沿与最初传播方向相同的方向继续传播的光称为前向散射 (FSC),并提供有关细胞相对大小的信息;更大的细胞产生更多的FSC。向其最初行进路径侧向散射的光称为侧向散射 (SSC),并提供有关细胞复杂性的信息。具有高度内部复杂性(例如广泛的膜)的细胞会产生更大的 SSC。
蛋白质表达,使用荧光蛋白融合测量
除了可见光外,流式细胞仪还可以有多种荧光光源。当用荧光光源询问时,表达相关荧光团或被相关荧光染料染色的细胞会发出被检测器捕获的荧光信号。
发射光子的强度因细胞而异,具体取决于荧光水平。与表达低水平蛋白质的细胞相比,表达高水平荧光团或荧光染料染色蛋白质的细胞会发出更强的光子。电气系统将荧光强度转换为电压脉冲,称为事件,并根据强度将每个事件分配给通道编号。更高强度的事件被分配给更高的通道。在典型的分析中,用户将比较事件的变化强度。由于强度与表达呈正相关,细胞从阴性对照转移得越远,表达水平就越高。
常规流式细胞术实验使用 2 或 3 种不同的荧光颜色,每种荧光颜色测量不同的目标。然而,流式细胞仪用途广泛,有些可以容纳多达 30 种不同的颜色。这使得流式细胞仪特别适用于查看各种不同目标的复杂实验。如果您计划在实验中使用荧光蛋白并且不确定选择哪一种,请查看 Addgene 的文章:我应该使用哪种荧光蛋白?
然而,融合蛋白在蛋白质的 N 端或 C 端用荧光报告基因标记您感兴趣的蛋白质。融合蛋白的一个缺点是标签可以改变蛋白质的结构。在某些情况下,这可能导致蛋白质功能发生变化或完全丧失。此外,表达的水平和时间也会受到标签的影响。
蛋白质表达,使用抗体偶联荧光团测量
荧光抗体通过与天然状态的蛋白质结合来解决荧光蛋白融合的挑战。基于抗体的流式细胞术可以使用直接和间接染色方法。在直接染色中,针对目标的一抗与荧光染料结合。在间接染色中,一抗与靶标结合,荧光染料偶联的二抗与一抗结合。直接染色比间接染色更快,并且消除了使用二抗可能产生的潜在非特异性染色。它还特别适用于可能阻碍大型免疫复合物结合的细胞内染色。当表达水平较低时,间接染色可能是有益的,因为多个二抗可以与一抗结合,从而放大信号。
细胞内蛋白质靶点,通过固定和透化膜测量
对于细胞内蛋白靶点,用户必须先将蛋白固定在细胞内,然后透化细胞膜,让抗体通过细胞膜。甲醛固定在赖氨酸残基之间产生交联,从而保留蛋白质结构并保持表位完整。然而,它不会透化细胞,需要随后用去污剂(例如 triton-x、皂苷或吐温)进行透化。使用强效去污剂(如 triton-x 和 tween)时要小心,因为延长处理会裂解细胞。醇类,如乙醇或甲醇,通过使蛋白质变性和溶解脂质(包括细胞膜的脂质),一步固定和渗透。在某些情况下,这可以掩盖表位,使免疫复合物不再识别它们。有时,用户将结合方法并首先用甲醛固定以将所有东西冷冻到位,然后再进行酒精渗透。用户在计划固定时还应牢记他们的目标。如果同时染色细胞表面和细胞内蛋白,则先染色表面蛋白,固定和透化,然后染色细胞内靶标。使用这种方法时,请避免使用对固定敏感的荧光染料,例如藻红蛋白 (PE) 和别藻蓝蛋白。如果测定分泌蛋白,首先用 Brefeldin A 阻断高尔基体以抑制分泌,然后遵循典型的细胞内染色方案。然后先对表面蛋白进行染色,固定透化,再对细胞内靶点进行染色。使用这种方法时,请避免使用对固定敏感的荧光染料,例如藻红蛋白 (PE) 和别藻蓝蛋白。如果测定分泌蛋白,首先用 Brefeldin A 阻断高尔基体以抑制分泌,然后遵循典型的细胞内染色方案。然后先对表面蛋白进行染色,固定透化,再对细胞内靶点进行染色。使用这种方法时,请避免使用对固定敏感的荧光染料,例如藻红蛋白 (PE) 和别藻蓝蛋白。如果测定分泌蛋白,首先用 Brefeldin A 阻断高尔基体以抑制分泌,然后遵循典型的细胞内染色方案。
使用 FACS 对单元格进行排序
除了流体、光学和电子系统之外,FACS 仪器还具有可以转移一部分细胞的专用组件。在 FACS 期间,样品流振荡产生液滴,当它们通过金属偏转板时带电。每个液滴都包含一个针对所需参数进行评估的单元格。将含有对所需参数呈阳性的细胞的液滴收集在管或板中,而丢弃含有阴性细胞的液滴。FACS 可以无菌进行,允许用户在收集后培养细胞。许多 FACS 分选机与作为收集容器的 96 孔板兼容,并且可以将单个细胞分选到每个孔中,从而使用户能够轻松分离并随后扩展单克隆培养物。
解读流式细胞仪数据
要解释流式细胞术数据,用户通常会从创建 FSC 与 SSC 的点图开始,以便他们观察不同的细胞群并排除死细胞和碎片。例如,全血样本将包含多种细胞,包括粒细胞、淋巴细胞和单核细胞。由于大小和复杂性的差异,这些细胞类型将在 FSC 与 SSC 图上分成不同的群体(图 2)。
然后,用户可以围绕他们感兴趣的特定群体“选通”,并进一步分析该细胞子集。例如,免疫学家可能对淋巴细胞感兴趣,并“控制”该群体以进行进一步分析。由于不同的免疫细胞群表达独特的分化细胞表面标记 (CD) 簇,因此这些标记可以在流式细胞术实验期间用特定的荧光抗体靶向,并将显示为不同的群体。在最初对淋巴细胞进行门控后,然后可以创建 CD3(T 细胞标记)与 CD19(B 细胞标记)的点图,以将 B 细胞和 T 细胞分成不同的群体(图 2)。研究 B 细胞的免疫学家,然后可能会对 B 细胞群进行门控,并创建含有 CD19 的细胞与总细胞数的直方图,以确定该样本中 B 细胞的数量。或者,他们可以创建各种 CD 标记的附加点图,以进一步将 B 细胞群分为祖 B 细胞、未成熟 B 细胞、浆细胞或其他细胞。
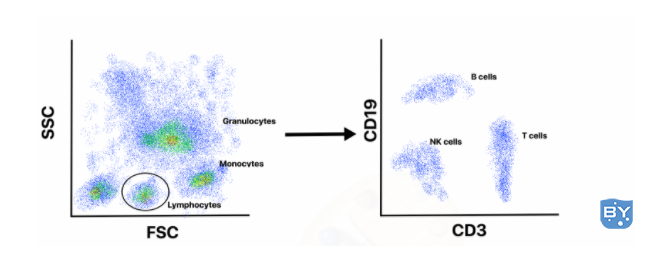
图 2:由于大小和复杂性的差异,全血样本中的细胞将在前向散射 (FSC) 与侧向散射 (SSC) 图中分离成不同的单核细胞、淋巴细胞和粒细胞群。用户可以围绕他们想要的细胞群进行进一步分析。在此示例中,通过绘制 CD3 与 CD19 来选择和分析淋巴细胞群以分离 B 细胞、T 细胞和自然杀伤 (NK) 细胞。
流式细胞术成功的技巧
分解细胞团块
流式细胞术实验的成功取决于多种因素,包括样品制备、染色程序和对照。为防止仪器堵塞,请确保样品为单细胞悬浮液。对于倾向于聚集的细胞,在仪器上运行之前,将样品通过尼龙网细胞过滤器以分解团块。为了维持细胞健康并减少碎片,请始终将样品放在冰上,并使用轻柔的移液器代替涡旋。
包括适当的控制
为了确保准确的数据分析,包括一整套控制。理想情况下,每个流式细胞术实验都会有一个不表达目标的阴性对照和一个表达目标的阳性对照。阴性对照对于确定非特异性染色的背景水平至关重要。
如果您使用抗体进行检测,请在未染色的对照中加入经过染色程序的细胞减去抗体。未染色的对照可让您检测来自目标细胞类型或固定产生的任何自发荧光。还包括同种型对照,一种不与任何靶标结合但在相同宿主物种中产生的抗体,具有相同的 Ig 亚类,并与您的一抗结合相同的荧光染料。同种型对照允许您确定与一抗相关的非特异性染色水平。当遵循间接染色方案时,您还应该包括一个二抗对照,其中一抗已从染色方案中省略。此控件允许您检测由二抗引起的背景染色。
还建议用户包括活力控制,因为这将允许您从分析中忽略死亡或垂死的细胞;死亡或垂死的细胞往往具有更多的自发荧光和非特异性染色,从而导致假阳性。许多染料可用于活力控制,例如 DNA 结合染料和胺活性染料。DNA 结合染料,如碘化丙啶,只能进入细胞膜破裂的细胞,就像死亡或垂死的细胞一样。DNA 结合染料与需要固定和透化的方案不兼容,因为这些方法需要破坏细胞膜并导致所有细胞染色呈阳性。如果需要固定和透化,例如在细胞内染色中,请考虑使用胺活性染料,例如 LIVE/DEAD 染色。像 DNA 结合染料一样,胺类活性染料只能通过死细胞的膜。一旦进入细胞,胺活性染料与细胞质中的游离胺相互作用,导致死细胞发出荧光。
运行多色流式细胞术实验时,用户还必须准备多组对照以帮助进行补偿。补偿是校正荧光染料之间发生的光谱重叠的过程。例如,FITC 染料发射绿色、黄色和橙色光子,而 PE 发射黄色和橙色光子。如果 FITC 和 PE 在实验中一起使用,您需要一种方法来确定 FITC 和 PE 中黄色和橙色的相对贡献。在补偿期间,由特定荧光染料产生的信号会从除其专用检测器之外的所有其他检测器中移除。为确保适当的补偿,您必须在实验中包含每种荧光染料的单染样品。单染样品必须与任何实验样品一样亮或更亮。此外,您应该包括一组“荧光减一”对照,用实验中除一种以外的所有荧光染料染色的样品。荧光减一面板将帮助您在数据分析期间设置门控。
我们希望这篇博客为您提供了用于单细胞分析的流式细胞术的概述,以及一些用于设置基于抗体的流式细胞术实验的有用背景信息。
 文章推荐
文章推荐