
纯化的另一个重要目的是有效去除灭活收料液中的内源逆转录病毒样颗粒,以及未检测到的外源病毒。
病毒如何去除与灭活
抗体生产常用的CHO和NS0细胞系都分泌内源逆转录病毒样颗粒。这些颗粒不具备感染能力,但为了安全,需加以清除。
在细胞培养中,环境或原材料中夹杂的外源病毒有可能感染并利用细胞大量复制。外源病毒感染有可能通过在线或离线检测发现,及时终止生产,阻断传播。但病毒感染也有可能不能及时发现,造成病毒随抗体药物进人下游环节。
需要指出的是,虽然存在这种间接感染的可能性,到目前为止还没有发现任何通过使用抗体药物感染病毒的案例。
控制病毒风险需要从三方面入手:
1、控制原材料和工艺,减少病毒污染;
2、利用原材料和中间产品检测及时发现污染;
3、在纯化步骤中建立足够的病毒灭活去除能力,清除未发现的病毒。
抗体纯化中的各层析步骤都有不同程度的病毒灭活去除能力,尤其是阴离子交换。在阴离子交换中性上样条件下,病毒带负电荷,会吸附在阴离子交换介质上,而抗体则带正电荷流穿。蛋白A亲和层析和深层过滤也有很强的病毒去除能力。
Zhou等发现,常用的深层过滤器对4种测试的模型病毒都有显著的去除作用,其中对鼠细小病毒的去除能力超过4Log1010。在纯化步骤本身的病毒去除能力基础上,抗体纯化还包括两个正交的专属病毒灭活去除步骤,即低pH孵育和病毒过滤。
病毒种类繁多,对病毒去除灭活的敏感度不同,需使用具有广泛代表性的病毒作为模型病毒加以研究和验证。Miesegaes等分析了提交到美国FDA的抗体药物申报材料,发现逆转录病毒、细小病毒和疱疹病毒是病毒去除灭活验证最常使用的模型病毒。
3种病毒中的逆转录病毒和疱疼病毒为包膜病毒,体积大,理化抗性低。细小病毒则是无包膜病毒,体积小,理化抗性高。逆转录病毒中又以鼠白血病病毒最为常用,细小病毒中又以鼠细小病毒最为常用。采用鼠白血病病毒的原因是用于模拟宿主细胞自身表达的内源性逆转录病毒样颗粒。鼠细小病毒可以感染抗体生产用的主要宿主细胞,且体积小、理化抗性高,用来模拟难以去除的外源病毒。
ICHQ5A要求至少使用三种病毒进行病毒去除验证;而实际上一般会采用四种病毒进行病毒去除验证。MVM、MuLv、PRV以及Reo-3是目前CHO体系病毒去除验证较为使用较多的病毒(见下表)。
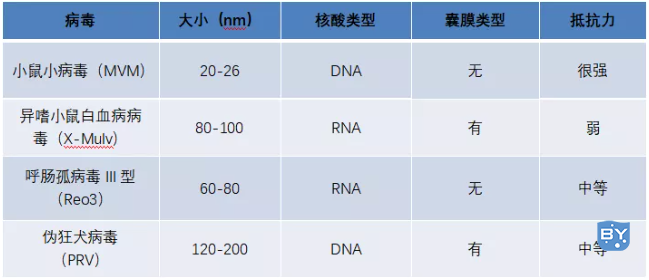
表CHO体系病毒去除种类要求
Miesegaes等的总结数据显示,对于逆转录病毒和疱疹病毒,蛋白A亲和、阳离子交换、阴离子交换、低pH孵育、50nm病毒过滤和20mn病毒过滤等纯化步骤都有较好的去除或灭活能力。
除阳离子交换层析清除逆转录病毒效率稍低(>3Log10)外,其他各步骤的平均清除能力都超过4Log10。对于体积小、理化抗性高的细小病毒,低pH孵育、蛋白A层析、阳离子层析则没有显著的去除灭活效果,仅阴离子交换和20nm病毒过滤的去除能力超过4Log10。
低pH孵育是专属的病毒灭活步骤,对包膜病毒有极强的灭活作用。低pH造成病毒包膜上的蛋白结构、膜结构、衣壳结构变化,从而去除病毒的传染能力。低pH孵育步骤可以方便地置于ProteinA层析后,在低pH洗脱液的基础上,调整pH,进行0.5-2小时的孵育。
Brorson等系统研究了pH、时间、温度、抗体浓度,缓冲液渗透压,宿主细胞杂质,抗体聚集在低pH孵育中对鼠白血病病毒的灭活作用,发现在很宽的操作条件下,低pH孵育能可靠地实现超过4-6Log10的滴度(见下图)。
需要指出的是,低pH对抗体有多种不利影响,包括促进抗体聚集、断裂、加速脱酰胺化等,所有在确定孵育pH、孵育时间等参数上,需要平衡考虑对病毒灭活和抗体质量的影响。
低pH孵育完成后,利用Tris等弱碱溶液进行中和。在中和过程中常会伴有沉淀产生,这些沉淀主要是宿主细胞蛋白和核酸等杂质,可通过深层过滤去除。增大细胞分离步骤使用的深层过滤面积可以减轻pH中和步骤沉淀产生。低pH孵育对鼠细小病毒等无包膜病毒没有明显的灭活效果。
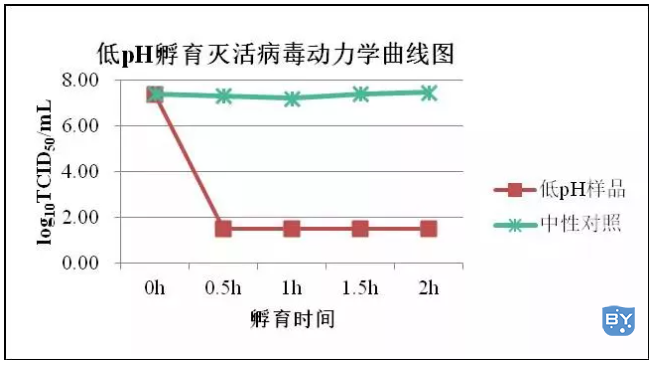
图:低pH孵育灭活病毒动力学曲线图
国内IND申报时,一般选择低pH和膜过滤这两个工艺。国外进行申报时,除了选择低pH和膜过滤,还需进行层析工艺。
层析法最常用的是亲和层析和离子交换层析。层析法是目前常用的样品不同组分分离技术,利用各组分与固定相亲和力的差异或相互作用不同的原理,实现病毒与样品分离的目的。国内的指导原则虽然没有硬性的规定,但通常需要做三个批次。
在国外的指导原则中,明确指出至少分别做两次独立的研究来证实清除的可重复性,因此一般是一批样品重复两次(见下表)。
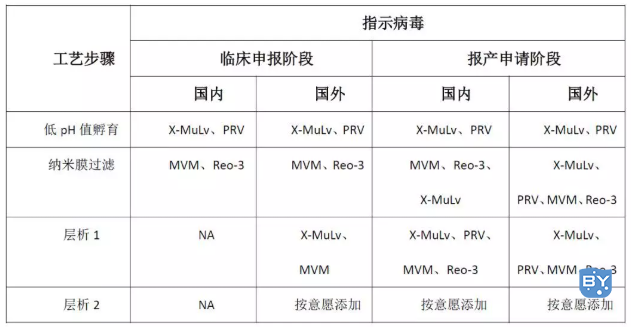
表:国内外申报资料病毒去除和灭活的比较
病毒过滤是另一个专属的病毒去除步骤,通过纳米级的孔径截获抗体中的病毒。病毒过滤受工艺本身变化的影响很小,是可靠的病毒去除步骤。
在抗体纯化工艺中,小孔径(去除20mn及以上病毒的细小病毒)滤器的应用远远超过大孔径(去除50mn及以上的逆转录病毒)滤器。这主要是因为低pH孵育对细小病毒无去除灭活作用,需要20mn滤器作为有效的小粒径病毒去除步骤。
Miesegaes等的总结说明,50mn滤器的鼠细小病毒的平均去除效果在2Log10左右,而20nm滤芯的去除能力能达到4Log10以上。
病毒过滤主要采用死端过滤。死端过滤操作简单,而切向流过滤在操作复杂的同时,其剪切力有可能造成抗体聚集。病毒过滤滤器价格昂贵,单位膜面积价格是无菌滤器的10倍,所以在工艺优化中需提高单位面积通量,以降低生产成本。
病毒过滤通常置于纯化完成之后,减轻杂质对滤膜的阻塞。尽管如此,病毒过滤前需要使用0.2um或0.1um的无菌滤器或深层过滤滤器进行预过滤,进一步去除宿主细胞杂质和抗体聚集体。
死端病毒过滤使用空气在上游储罐保持固定压力,压力越高,单位体积的过滤速度和载量越高,但压力不应高于滤芯建议的使用压力。
在过滤过程中,过滤速度会逐渐衰减,衰减速度直接影响到过滤的载量。抗体浓度对过滤有直接影响,浓度增加,过滤速度降低。浓度降低,需要滤过的液体体积增加。具体最佳的抗体浓度,需要针对性地通过实验确定。
讲一讲:超滤换液
超滤膜系统是以超滤膜丝为过滤介质,膜两侧的压力差为驱动力的溶液分离装置。超滤膜只允许溶液中的溶剂(如水分子)、无机盐及小分子有机物透过,而将溶液中的悬浮物、胶体、蛋白质和微生物等大分子物质截留,从而达到净化和分离的目的。
超滤在治疗性蛋白以及试剂蛋白的纯化过程中是比较关键的步骤,用于替换缓冲液和浓缩。小规模的时候,水和小分子可以通过离心或压力的方式透过半透膜,蛋白浓度在膜表面浓度会变得很高,在抗体超滤过程中,尤其在低温过程超滤时,易出现浑浊现象,而加入精氨酸可以降低聚体的形成。
治疗性抗体由于需要高剂量,因此需要超滤至高浓度,高蛋白浓度会形成高粘度,而且需要更合适的处方,然而超滤过程中形成高蛋白浓度与小的亲水半径有关,甚至是2nm,在proteinA层析低pH洗脱的时候也出现小的水合半径,只有溶菌酶的10倍小。这主要是由于处于低盐或pH下,静电作用不能完全被隔离,而在高蛋白浓度下,过量的体积占主要作用。
综合以上所述
纯化的整个层析过程:
1、平衡
使层析柱处于可使用的状态,用于维护良好的结合条件并定义色谱曲线的基线零点。
2、上样
目标分子与介质能够充分,均匀有限接触,实现结合的过程。上样量,上样流速等对分离过程都有很大影响,需要实验摸索最佳上样过程。
3、洗杂
将介质表面,孔内,间隙残留的未和介质结合的物质洗掉。
4、洗脱
将结合在介质上(包括孔内和表面)的物质逐步洗脱下来,洗脱过程又可分多步进行,把结合强弱不同的物质分开,实现分离的目的。
5、维护
维护包括再生,清洗,消毒,保存。
另外抗体纯化的主要任务为:
1、工艺优化
亲和工艺、精纯工艺、除病毒灭活与过滤工艺;
2、小试纯化
用于药理、毒理、稳定性等研究提供样品;
3、
工艺放大及中试生产将优化后的工艺进行规模放大,使其适用于200L工艺,同时生产出用于临床申报的产品;
4、文件书写
用于临床申报及工艺转移的文件。
参考文献:
1、Affinity Chromatography:Methods and Protocols-Third Edition
2、Downstream industrial biotechnology-Recovery and purification
3、Ultrafiltration for Bioprocessing-Development and Implementation of Robust Processes
4、Protein Purification-Second Edition
 文章推荐
文章推荐