
表达您感兴趣的蛋白质但不确定它是否正确折叠?继续阅读以发现重折叠蛋白质的建议和技巧。
包容性机构的问题
细菌蛋白质表达是获得大量蛋白质用于分析、结构研究等的好方法。但是,当您多次表达重组蛋白并且它拒绝在您的纯化过程中出现,而是停留在包涵体 (IBs) 中时,方便常常会变成挫败感。当您的蛋白质在表达过程中没有正确折叠时,就会发生这种情况,这个问题可以通过蛋白质复性来解决。
在本文中,我们将讨论解决 IB 问题并检查您的蛋白质是否正确折叠和功能的方法。
如果您正在寻找让细菌首先表达您的目标蛋白的技巧,请参阅我们的文章,了解在细菌系统中表达蛋白质和优化细菌蛋白质表达之前要记住的几点。
为什么我需要对我的蛋白质进行再生?
大多数关于蛋白质的实验——例如,通过晶体学或其他方法发现其结构,跟踪其在细胞中的定位,或在动物模型上进行测试——都需要将其折叠成其天然构象,这可能需要以下结构形式:
二级结构包括αa l p h a-螺旋和测试版最好的_ _-床单;
三级结构基序,例如亮氨酸拉链、锌指和二硫键;
和四元结构,例如二聚体、四聚体和更大的复合物。
您的蛋白质应该在您的溶液中溶解或正确结合到固体表面。如果蛋白质错误折叠,与自身的其他分子聚集,并从其溶液中崩溃,则其天然结构可能无法达到其当前的能量状态(图 1),否则大多数实验将缺乏生物学相关性。
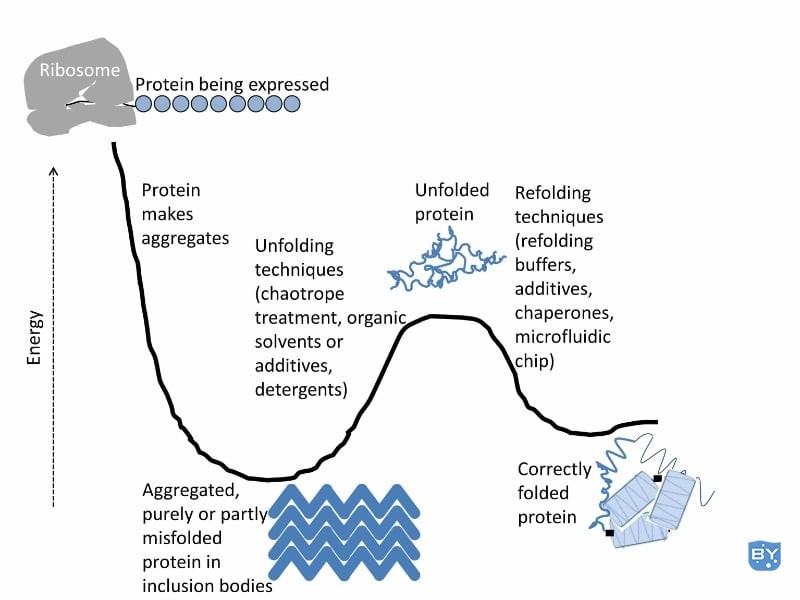
图 1.蛋白质聚集成包涵体,因为这是一种低能状态,当它们缺乏引导它们通过正确折叠过程所需的翻译后修饰和伴侣时,它们会默认进入这种状态。展开技术打破了能量屏障,使蛋白质变性为更高的能量状态,然后可以通过复性技术和试剂引导它折叠成其天然结构。图片来源:N. Kegulian。
细菌表达的缺点
在细菌系统中表达重组蛋白,尽管具有包括可负担性和通常高产率在内的实际优势,但当目标是真核蛋白时具有缺点。让我们更详细地看一下这些。
有问题的翻译后修饰
细菌细胞缺乏向蛋白质添加翻译后修饰 (PTM) 的机制,这是真核细胞功能的标志。缺乏 PTM 不仅会导致在实验中评估蛋白质的生理相关功能受到限制,而且可能会禁止正确折叠到其天然结构中,这应该在表达时发生。
伴侣不足
此外,虽然细菌确实表达了引导蛋白质正确折叠的伴侣蛋白,但表达方案通常涉及过度表达以大量产生靶蛋白,从而迅速耗尽细菌细胞的天然伴侣蛋白机制。
因此,文献中充满了关于细菌表达的重组真核蛋白的描述和操作方法,这些蛋白最终在 IBs 中出现,IBs 是宿主细胞内部或外部的蛋白质沉积物,其中表达的蛋白质已经聚集并从溶液中消失。[1-5] 在这种 IB 状态下,蛋白质是不溶的,不能按原样用于实验。
成功重新折叠蛋白质需要什么?
由于大小、电荷和疏水性等性质的广泛变化,不同的蛋白质对相同的处理反应不同;因此,没有一种万能的方法。但别担心,我们将向您介绍一系列重新折叠蛋白质的方法,因此您一定会找到适合您实验的方法。
提示 1:首先,从包涵体中拯救蛋白质
通过大多数常规方案从 IB 中溶解蛋白质需要用浓缩的变性剂或离液剂处理它,通常是浓度为 6-8 M 的尿素或盐酸胍。[2,3] 或者,您可以使用强洗涤剂,例如钠十二烷基硫酸盐 (SDS) (2% w/v)。[5]
变性剂通常作为生理 pH 缓冲液的一部分存在,用于反复清洗 IB 直到它们溶解。洗涤通常包括对缓冲液中的 IB 进行超声处理或将 IB-缓冲液混合物置于摇杆上的试管中,与离心步骤交替进行。您可以对离心后的沉淀和上清液进行蛋白质印迹,以检查您的蛋白质是否成功地从上清液中分离出来。
在这个增溶步骤结束时,蛋白质应该被溶剂化。然而,为了使其可用,它必须被复性,因为变性蛋白质完全或几乎完全展开,并被离液剂或去污剂阻止形成其天然结构。必须通过稀释、透析或不太常规的方法(见下文)去除变性剂。
提示 2:寻找重折叠蛋白质的方案
弄清楚您的方案的一个很好的早期步骤是在 REFOLD 数据库中查找您的目标蛋白,[6-8] 该数据库提供了数千种方案(在撰写本文时为 2060 种重折叠方法)用于复性不同的蛋白质。
如果那里没有列出您的蛋白质,或者列出了但建议的方法对您不起作用,请不要惊慌!我们仍然有很多提示和技巧供您尝试,请继续阅读。
提示 3:尝试稀释或透析
溶解 IBs 的主要常规方法是稀释和透析。稀释仅仅意味着变性剂或离液剂中的蛋白质在重折叠缓冲液中被稀释。透析包括将变性蛋白质置于半透性袋或具有半透膜的管中,然后将其漂浮在(至少)1000倍体积的重折叠缓冲液中。
其原理是重折叠缓冲液逐渐取代管或袋内的变性剂溶液,而透析膜的孔径选择太小以使蛋白质本身泄漏到外部缓冲液中。
这些方法有缺点。稀释后,产生的大量高度稀释的蛋白质(通常从其在变性剂中的原始浓度稀释 100 到 1000 倍)可能在实验中没有用,并且在稀释过程中,随着变性剂变成更稀释,而蛋白质本身变得更稀释。[9]
透析还可能导致变性剂浓度下降过快而无法继续防止蛋白质聚集。[9]
在逐渐充分稀释或更换变性剂和用重折叠缓冲液有效促进天然折叠之间取得平衡,取决于您的特定蛋白质对稀释或透析条件的反应。
获得更好结果的非常规技术
对于特别棘手的重折叠蛋白质,您可能需要超越稀释和透析。
技巧 4:在梯度上固定和重折叠蛋白质
在某些情况下,将蛋白质固定在色谱柱上,然后在重折叠缓冲液中将其稀释,以防止聚集。[10]
提示 5:用过的洗涤剂?沉淀出来!
如果您使用 SDS 作为变性剂而不是尿素或盐酸胍(参见上面的提示 1),稀释和透析不会减少它。众所周知,SDS 很难删除。
生化学家 He 和 Ohnishi [5] 最近通过添加 400 mM KCl 并在 4°C 下孵育混合物过夜,成功地沉淀出 SDS(他们曾用作变性剂),从而纯化了绿藻硫化多糖裂解酶蛋白。高效液相色谱 (HPLC) 中的反相柱也可以去除 SDS。[5]
提示 6:购买重新折叠套件
如果您不知道从哪里开始,选择正确的重折叠缓冲液、色谱柱和透析或稀释步骤的大小可能就像大海捞针一样。
幸运的是,为了优化条件,现在可以使用试剂盒通过矩阵系统筛选正确的重折叠缓冲液和色谱柱,从而省去从头开始设计和执行您自己的故障排除实验所需的大量时间。
Pierce™ 蛋白质重折叠试剂盒和Athena Sciences 的 QuickFold™ 蛋白质重折叠试剂盒是旨在筛选您的病症的商业选项的示例。有时需要进行冻干步骤以将蛋白质保持在重折叠状态直到它可以使用,或者在不同于重折叠缓冲液的反应缓冲液中将其再水合。
技巧 7:使用微流控芯片
另一个值得尝试的工具是微流控芯片。当变性蛋白在芯片上从中心流向层流流动时,它会遇到一个或多个连接点,通过这些连接点从变性溶液流向重折叠缓冲液。[9] 芯片设计中的连接点越多,从缓冲液到缓冲液的步骤越多,因此缓冲液的变化越平缓,与经典的一步透析或稀释相比,降低了聚集的风险。[9]
提示 8:添加剂!
一种或多种化学添加剂可能是重新折叠蛋白质的关键。已观察到氨基酸精氨酸和脯氨酸以及非经典氨基酸精氨酸酰胺和甘氨酸酰胺抑制聚集,从而促进重折叠过程。[9]
如上所述,通常以高浓度使用尿素和盐酸胍使蛋白质变性,在低浓度时可以抑制聚集并促进再折叠。[9] 甘油、聚乙二醇和蔗糖和海藻糖等糖类在重新折叠过程中可以稳定一些蛋白质结构,[9] 温和的去污剂如胆酸盐、Triton X-100 或 3-[(3-cholamidopropyl)二甲基铵]-1-丙磺酸盐(CHAPS)。[11]
提示 9:带上陪护
或者,您可能需要重建宿主细菌细胞在表达蛋白质时未能做到的事情:使用伴侣引导蛋白质进入正确的结构。环糊精已被证明可用作该技术的人工伴侣,因为它们通过在疏水腔中捕获蛋白质以及环糊精的亲水基团与蛋白质的亲水基团之间的弱相互作用与靶蛋白相互作用。[9]
提示 10:不使用变性剂溶解
许多蛋白质形成的 IBs 被发现含有错误折叠和正确折叠蛋白质的平衡混合物。[12] 对于此类蛋白质,从 IB 中变性然后复性的替代技术是在不进行变性步骤的情况下从 IB 中溶解正确折叠的蛋白质。
一些增溶剂 [如肌氨酸和低浓度 (5%) 的二甲基亚砜 (DMSO) 和正丙醇] 是完全非变性的,无需再折叠。[12]
用高 pH 缓冲液 (>12)、高浓度 (6 M) 有机溶剂 ([例如测试版最好的_ _-巯基乙醇(BME)],或施加高压(2-4 kbar)会溶解,但会有些破坏,而不会完全变性目标蛋白的结构。
这将需要随后重新折叠蛋白质,但与变性方法相比,蛋白质聚集的损失要低得多。[12](但是,请注意使用 BME 来溶解依赖于其二硫键以实现稳定性和功能的蛋白质,例如被 BME 不可逆变性的核糖核酸酶。[13])
提示 11:注意你的 C
半胱氨酸使蛋白质能够形成二硫键,这在溶解、变性和复性步骤中需要考虑。可能是您的含半胱氨酸蛋白质在 IB 中错误折叠时形成了错误的二硫键。
您需要通过在变性溶液中加入强还原剂(例如二硫苏糖醇 (DTT))来释放这些键。然后,重折叠缓冲液应包含优化平衡的氧化还原剂,[10] 例如比例为 10:1 至 1:1 的还原型和氧化型谷胱甘肽的混合物,或者 10:1 的半胱氨酸-胱氨酸对1个比率。
这将建立一个氧化还原平衡,当您的蛋白质重新折叠时,该平衡将促进正确二硫键的形成,同时抑制不正确的二硫键形成。与整体重折叠一样,您可能需要一个故障排除步骤来根据它们对蛋白质的影响来调整和重新调整这些量。
完全绕过包含体的技术
如果正确地重新折叠蛋白质的最佳工具仍然难以捉摸,那么在某些时候,您将希望通过首先避免 IB 形成来规避变性/复性的需要。
提示 12:添加标签!
许多蛋白质已经成功地用硫氧还蛋白、谷胱甘肽 S-转移酶或麦芽糖结合蛋白标签表达,并且很容易溶解在裂解缓冲液中而不形成 IB。然而,您的实验可能需要您使用没有标签的蛋白质。
尽管如此,作为下游步骤切割标签更容易控制蛋白质折叠的状态——通常是通过调节缓冲液的pH 值,包括有机溶剂,或稀释蛋白质 [14,15]——而不是当蛋白质仍在细菌细胞。
技巧 13:去除有问题的残留物
也许只有一小群氨基酸,或者只是一个氨基酸,会导致您的目标蛋白在表达过程中聚集。
Hamodrakas等人开发的在线工具。[16] 可以帮助您预测触发 IB 形成的多肽区域。如果这些残基对您的实验并不重要,您可以尝试在没有它们的情况下表达蛋白质。
技巧 14:分而治之
也可以选择表达蛋白质的一个或多个结构域,而不是整个蛋白质。一些实验效果很好,甚至更好,只使用相关的蛋白质片段。
大蛋白质可以分为模块——通常根据功能性、疏水性和亲水性氨基酸为主的区域,或编码外显子——并且不溶性模块可以被排除在表达载体之外(参见 Loftus等人[17] 和 Gross等人) al. [18],例如)。
提示 15:使用真核生物
最后,您可以考虑通过不使用细菌细胞进行蛋白质表达来避免形成 IB。昆虫细胞是一种广泛优化的真核表达系统,可以大规模制造目标蛋白,并用适当的伴侣和翻译后修饰对其进行处理。
技巧 16:抛弃细胞
另一种可能性是根本不使用细胞。无细胞表达系统会产生较低浓度的蛋白质,从而不太可能形成 IB,并且由于仅包含您实际放入系统中的大分子,因此可以灵活地添加共溶物或进行其他修饰以优化保存目标蛋白的天然结构。
蛋白质重折叠有效吗?
一旦您在选择的缓冲液中获得了良好的蛋白质产量,您仍然需要检查结构以确保其折叠成其天然构象。
如果你的实验的一部分是研究一种蛋白质的结构,因为它一开始并不为人所知,那么你的工作中就内置了这种检查,尽管如果你不知道你的结构是什么,就很难判断结构是否正确。重新寻找!
技巧 17:使用圆二色性检查重折叠
圆二色性(CD) 是评估溶解度和二级结构的理想方法,因为它根据蛋白质样品是否包含无序区域来揭示具有特征峰的光谱,测试版最好的_ _-床单,测试版最好的_ _-转身,αa l p h a-螺旋和/或聚脯氨酸螺旋。[19]
您可能知道一种相关蛋白质,其结构可能与您的新蛋白质相似,或者您可以使用 PSIPRED 或 AlphaFold [20,21] 等软件来预测目标蛋白质的结构。如果 CD 光谱在这些相似性或预测范围内的某个地方匹配,则可以肯定地说您的蛋白质已正确折叠。
此外,如果蛋白质正在聚集,它可能会在测量其不同等分试样的 CD 时显示不一致的光谱,甚至由于溶剂化不良而给出低 CD 信号。
技巧 18:尝试尺寸排阻色谱
如果您的蛋白质错误折叠和聚集不当,它的体积应该大于其所需的天然状态。这可以使用尺寸排阻色谱 (SEC) [4]或非变性聚丙烯酰胺凝胶电泳 (PAGE)(也称为天然凝胶)进行评估,以确定蛋白质以正确的分子量和横截面大小运行.
同样,如果您在实验室中有类似的蛋白质具有更好的理解行为,您可以将其通过 SEC 柱或凝胶中的相邻泳道作为阳性对照。
技巧 19:使用 SDS-PAGE 或非变性 PAGE 检查二硫键
凝胶还可以让您检查二硫键。如果预期的键是分子间键,简单地在有和没有强还原剂(如 BME)的情况下进行 SDS-PAGE ,[13] 会破坏所有二硫键,会显示在没有试剂的情况下,由于 Cys 导致蛋白质运行更慢 -半胱氨酸在分子之间架桥。
对于分子内二硫键,在含有和不含有 BME 的天然凝胶中运行蛋白质会更有帮助,因为可以通过这种方式查看超出分子量引起的大小变化,并且可以进行比较以评估是否已形成所需的二硫键.
提示 20:确定它是否有效
测试蛋白质重折叠的另一种方法是检查其功能。健康细胞倾向于处理未正确折叠的蛋白质。因此,放射性或荧光标记您的蛋白质并通过分别进行脉冲追踪或漂白剂追踪实验来跟踪其在细胞培养中的稳定性,可能是评估其重折叠的一种方法。
提示 21:监控蛋白质的相互作用
您的蛋白质是否与另一种蛋白质形成复合物,还是一种酶?桑托斯等人。[4] 通过测量其与肽聚糖的复合物形成,评估了 XfPal 的蛋白质-蛋白质相互作用,这是一种他们在表达后复性的蛋白质。在他们的情况下,复合物导致 XfPal 在进行一组离心后将可溶性部分留给不溶性部分。
检查蛋白质-蛋白质相互作用的另一种好方法是免疫共沉淀,然后进行蛋白质印迹,以检测您期望形成复合物的蛋白质。如果您的目标蛋白是一种酶,则可以通过动力学分析来测量功能,例如本文使用酶文章中描述的分析。
简而言之,重新折叠蛋白质
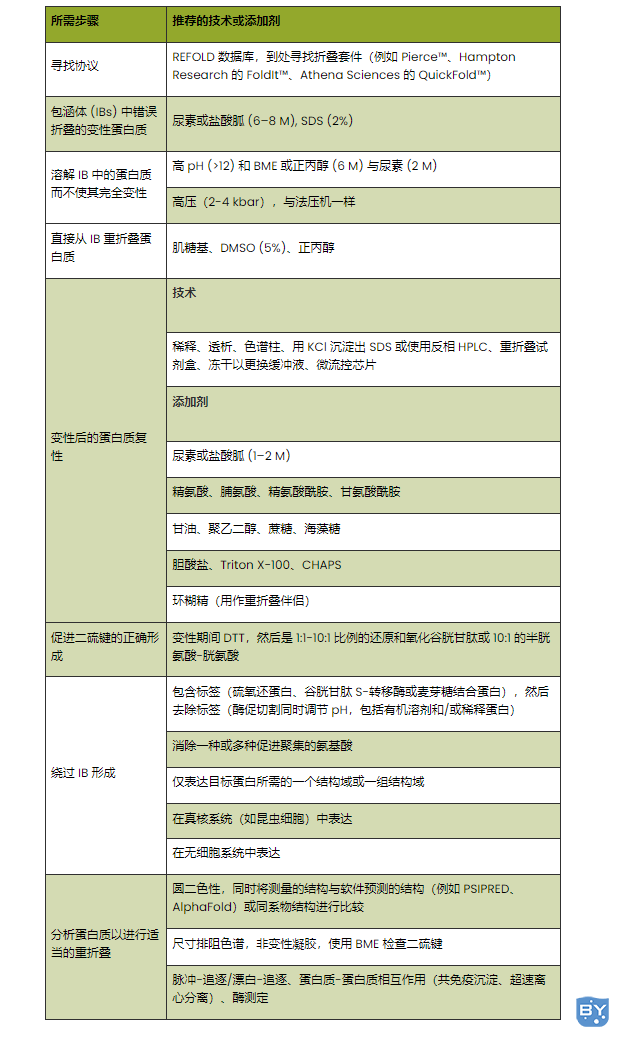
我们很欣赏这里有很多信息可以吸收,因此我们创建了一个方便的表格来概述本文中涵盖的蛋白质复性的各种步骤和工具。
表 1。成功进行蛋白质复性的步骤
正确折叠重组蛋白可能是一条漫长而曲折的道路,但我们希望这个提示和技巧工具包能帮助您实现目标。当您进行实验的时候到了,这一切都是值得的!
 文章推荐
文章推荐