
蛋白质的分离纯化在生物化学研究应用中使用广泛,是一项重要的操作技术。一个典型的真核细胞可以包含数以千计的不同蛋白质,一些含量十分丰富,一些仅含有几个拷贝。为了研究某一个蛋白质,必须首先将该蛋白质从其他蛋白质和非蛋白质分子中纯化出来。用于分离蛋白质的最重要特性有大小、电荷、疏水性和对其他分子的亲和性。通常采用多种方法的组合来实现蛋白质的完全纯化。
本文主要从蛋白纯化的定义、蛋白纯化的指导原则、蛋白纯化的方法选择、蛋白纯化标签的选择4方面内容给大家介绍。
一、蛋白纯化的定义
蛋白纯化技术是生物研究领域的一项重要技术。要研究某一个特殊蛋白质,首先就要将这个蛋白从生物体中分离纯化出来。蛋白纯化方法主要是利用不同蛋白间内在的相似性与差异,利用各种蛋白间的相似性来除去非蛋白物质的污染,而利用各蛋白质的差异将目的蛋白从其他蛋白中纯化出来。每种蛋白间的大小、形状、电荷、疏水性、溶解度和生物学活性都会有差异,利用这些差异可将蛋白从混合物中提取出来得到靶蛋白。
二、蛋白纯化的指导原则
1、明确目标:对于纯化样品,应该要明确最终产品需要达到的纯度、活性和产量的要求,要避免过度纯化或者因为纯化步骤或者分辨率不够而达不到想要的纯度。
2、明确目标样品的特性和关键杂质:根据样本和杂质的特性选择适合的纯化方法,纯化技术的选择要简单化,并且要产生最佳的纯化效果。
3、明确检测分析技术:能快速和准确的检测样品活性,纯度和回收率。
4、合理安排纯化步骤:尽可能少用添加剂和尽可能早的去除对样品有损伤的杂质,并且要减少额外的纯化步骤。
三、蛋白纯化的方法选择
蛋白纯化的原理为:不同蛋白质的氨基酸序列及空间结构不同,导致其在物理、化学、生物学等性质上存在差异,利用待分离蛋白质与其它蛋白质性质上的差异,即可以设计出一套合理的蛋白纯化方案。
蛋白的纯化大致分为前处理、粗分离阶段、精细纯化阶段和结晶4个阶段。
1、前处理(pretreatment):因动/植物/细菌而异
2、粗分级分离(rough fractionation):主要将目的蛋白和其他细胞成分如RNA、DNA等分开。采用盐析/等电点沉淀/有机溶剂分级分离等方法
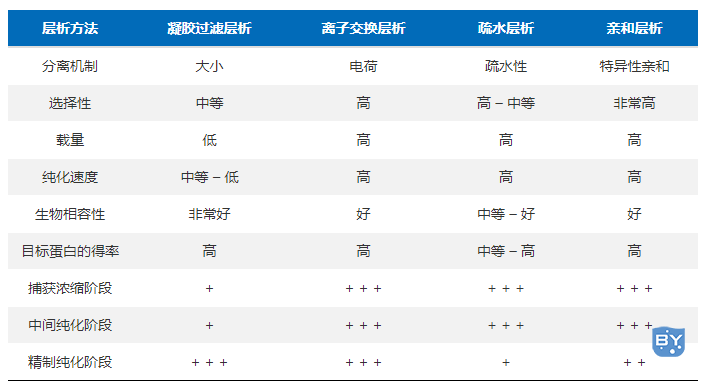
3、细分级分离(fine frationation):目的蛋白与其他大小及理化性质接近的蛋白区分开来。常用的方法有:凝胶过滤层析、离子交换层析、疏水层析、亲和层析等。
4、结晶:分离纯化的最后步骤。
(一)凝胶过滤层析
凝胶层析亦称凝胶过滤、排阻色谱或分子筛层析等。其机理是分子筛效应,主要根据蛋白质分子的大小进行分离和纯化。层析柱中的填料是某些惰性的多孔网状结构物质,多是交联的聚糖(如葡聚糖或琼脂糖)类物质。
1、单个凝胶珠本身象“筛子”。不同类型凝胶的筛孔的大小不同。
2、分子量大的物质不能进入凝胶粒子内部,随洗脱液从凝胶粒子之间的空隙挤落下来,所以大分子物质迁移速度快;
3、小分子物质要通过凝胶网孔进入凝胶粒子内部,所以小分子物质迁移速度慢。
4、一般来说,凝胶过滤层析柱越细、越长纯化的效果越好。
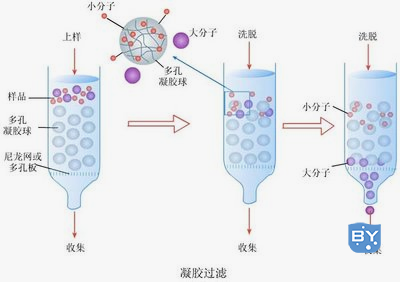
凝胶过滤层析所能纯化的蛋白分子量范围很宽,纯化过程中也不需要能弓|起蛋白变性的有机溶剂。缺点是所用树脂有轻度的亲水性,电荷密度较高的蛋白容易吸附在上面,不适宜纯化电荷密度较高的蛋白。
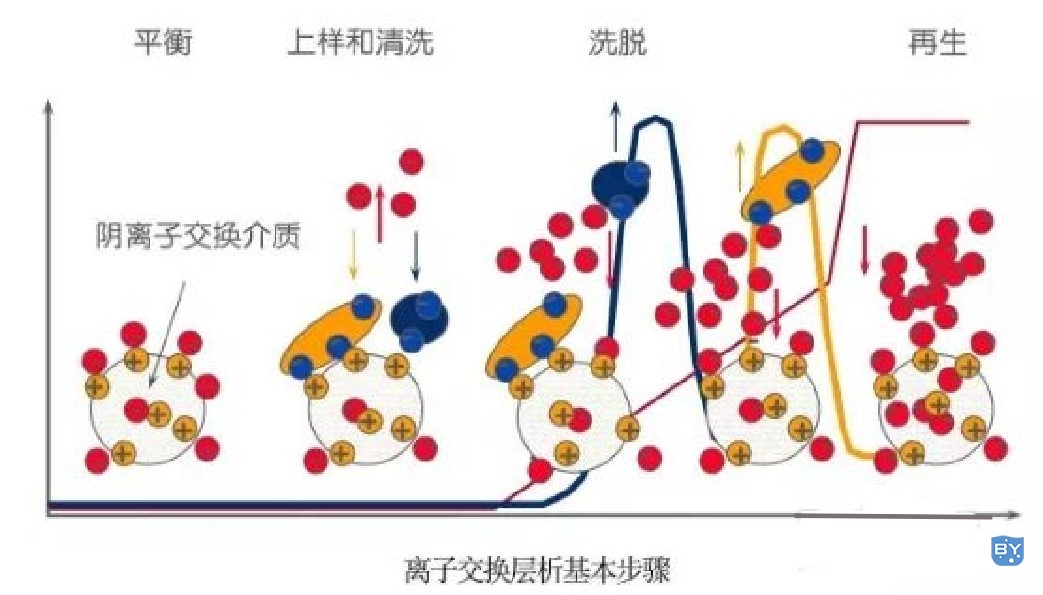
(二)离子交换层析
离子交换层析是一种依据蛋白表面所带电荷量不同进行蛋白分离纯化的技术。不同蛋白质的等电点(pI,isoelectric point)特性,使在不同pH缓冲液条件下所带正/负净电荷不同,选择不同的离子交换柱实现分离。
离子交换层析属于吸附性分离方式,纯化过程中它具有可逆、操控性强及实现样品浓缩等特点。在精纯实验中是常与其它方法相结合使用的主要技术。其实验操作如下所示:
(三)疏水层析
疏水作用层析是利用盐-水体系中样品分子的疏水基团和层析介质的疏水配基之间疏水力的不同而进行分离的一种层析方法。该法利用了蛋白的疏水性,蛋白经变性处理或处于高盐环境下疏水残基会暴露于蛋白表面,不同蛋白疏水残基与固定相的疏水性配体之间的作用强弱不同,依次用从高至低离子强度洗脱液可将疏水用作由弱至强的组分分离。
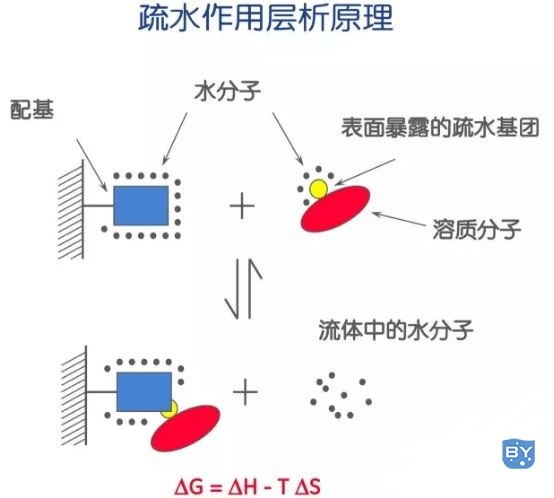
疏水作用层析实验操作成本低且纯化得到的蛋白具有生物学活性,是一种通用型的分离和纯化蛋白质的方法。该实验遵循“高盐上样,低盐洗脱”的原则:高浓度盐水溶液中蛋白质在柱上保留,在低盐或水溶液中蛋白质从柱上被洗脱,特别适用于浓硫酸铵溶液沉淀分离后的母液以及该沉淀用盐溶解后的含有目标产品的溶液直接进样到柱上,当然也适用7mol/盐酸胍或8mol/L脲的大肠杆菌表达蛋白提取液直接进样到柱上,在分离的同时也进行了复性。
(四)亲和层析
亲和层析纯化是利用生物大分子物质具有与某些相应的分子专一性可逆结合的特性进行蛋白纯化的技术。该方法适用于从成分复杂且杂质含量远大于目标物的混合中提纯目标物,具有分离效果好、分离条件温和、结合效率高、分离速度快的优点。
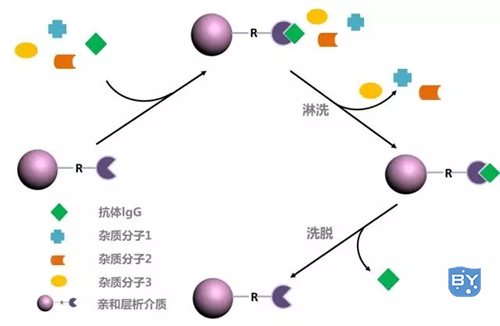
亲和层析技术可以利用配基与生物分子间的特异性吸附来分离蛋白,配体通常指的是能与另一个分子或原子结合(一般是非共价结合)的分子、基团、离子或原子。但在亲和层析中,配体是通过共价键先与基质结合,配体可以是酶结合的一个反应物或产物,或是一种可以识别靶蛋白的抗体。也可以在蛋白上加入标签,利用标签与配基之间的特异性结合来纯化蛋白。
标签纯化:利用基因工程技术在蛋白的氨基端或羧基端加入少许几个额外氨基酸,这个加入的标记可用来作为一个有效的纯化依据。选择合适的标签不但有利于蛋白的纯化,促进蛋白的可溶性,同时也不能影响蛋白的结构功能和下游应用。
(选自网络)
四、蛋白纯化标签的选择
蛋白标签大体可分为三大类:遗传标签、in vivo标签和in vitro标签,最为常用的是遗传标签,即c-Myc、FLAG等。通过将目的基因克隆到含有标签的载体上,方便在下游通过抗体、荧光检测蛋白,或对蛋白进行纯化,常见的蛋白标签包括以下几种:His,Flag,GST,MBP,c-Myc等。
那面对种类繁多的标签蛋白该我们该如何选择呢?
1、首先需要确定融合标签的目的,蛋白纯化首选His-Tag,Western blot首选Flag-Tag,免疫共沉淀可选择Flag-Tag或其他常用标签如HA、cMyc,活细胞成像则应该选择荧光蛋白等。
2、考虑融合蛋白的影响:任何一类标签位于氨基酸序列的任一位置,都有影响目的蛋白表达或其功能的可能。标签可能会干扰蛋白的正确折叠,或中断亚细胞的定位信号,因此需要考虑添加的标签是否对目的蛋白的表达有影响。
3、确定具体是标记在N-端还是C-端:根据蛋白结构、定位的特性选择标签蛋白标记的具体位置,若没有确切的蛋白结构,则可以都进行尝试,并选择更有效的标记。
(一)His标签
His标签被认为是蛋白纯化的首选标签,它是由六个组氨酸残基(HHHHHH)组成的融合标签,分子量极小只有~0.84KD,可插入在目的蛋白的C末端或N末端。组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
His标签的优缺点:
HIS-Tag本身的特性对目的蛋白没有影响,不会形成二聚体;
分子量较小,只有84KD,对蛋白的下游应用不会产生影响;
免疫原性低,可将纯化的蛋白直接注射动物进行免疫并制备抗体;
HIS-Tag与细菌的转录翻译机制兼容,有利于蛋白表达;
可与其他标签构建双标签表达,可用于多种蛋白表达系统,纯化条件温和对蛋白影响较小。
如Abbkine的PurKine™系列纯化工具https://www.abbkine.cn/product_cat/protein-purification
(二)Flag标签:
Flag融合标签是由八个氨基酸(DYKDDDDK )组成的短肽,专门设计用于重组蛋白质的免疫吸附纯化。Flag标签结构短小,且与融合蛋白质之间含有一个肠激酶切割位点,可以通过肠激酶切割被除去。
Flag标签的优缺点:
序列短小,仅由八个氨基酸组成,抗原肽可以只用一条人工合成的寡核苷酸链编码;
含有肠激酶切割位点,肠激酶可以识别该短肽C端的五个氨基酸( DDDDK),即可通过肠激酶处理除去标签获得天然的非融合蛋白质;
HA融合FLAG的目的蛋白,可以直接通过FLAG进行亲和层析,此层析为非变性纯化,可以纯化有活性的融合蛋白,并且纯化效率高;
目的蛋白N端融合了Flag多肽后,C末端还可以融合其他模块或者不同的亲和配体。
如Abbkine的BMR21504 PurKine™ Anti-Flag树脂(4%交联)
(三)GST标签:
谷胱甘肽s-转移酶(GST) 基因融合系统是用于从大肠杆菌中生产的GST-标签蛋白(26KD)的表达、纯化和检测的通用系统。可在非常温和的条件下对GST-标签蛋白进行纯化,从而保留目的蛋白的功能和抗原性。 GST标签可增加目的蛋白的溶解性和稳定性。GST标签很大,其相对分子量(Mr)为26000。一段特殊的切割序列允许在纯化后用不同的蛋白酶简单地去除GST标签
GST标签的优缺点:
由于GST为高度可溶的蛋白,因此增加了外源蛋白的可溶性;
GST可在大肠杆菌中大量表达,起到提高表达量的作用;
GST标签可以使用不同的蛋白酶方便去除
GST标签具有高特异性,纯化方便且温和
GST标签能够很好的保留蛋白的抗原性和生物活性。
如Abbkine的PurKine™系列纯化工具https://www.abbkine.cn/product_cat/protein-purification
(四)MBP-MBPTag (麦芽糖结合蛋白标签)
MBP (麦芽糖结合蛋白maltose binding protein),残基数346, 分子量42.5KDa,由大肠杆菌K12的malE基因编码,构建时刻放在N端,用来提高可溶性(尤其是真核蛋白)。MBP的折叠需要DnaK-DnaJ-GrpE和GroEL-GeoES两个分子伴侣系统的帮助,这可以使这些分子伴侣聚集到目的蛋白的附近帮助其正确折叠。另外,以标签蛋白形式存在的麦芽糖结合蛋白可以减少目的蛋白的降解,提高表达产物的水溶性,也为以后对目的.蛋白的纯化提供了基础。麦芽糖结合蛋白能够被多糖树脂吸附,因此在过柱时,能够使融合蛋白与其它蛋白成份分离。
MBP标签的优缺点:
简单亲和纯化即可实现;
增加蛋白表达量和蛋白稳定性; .
促进蛋白的可溶性和正确折叠;
标签较大,对蛋白的结构/功能会有一定影响。
如Abbkine的PurKine™系列纯化工具https://www.abbkine.cn/product_cat/protein-purification
(五)c-Myc标签
C-Myc标签蛋白,其序列为EQKLISEEDL,它作为抗原表位表达在不同的蛋白质框架中可识别其相应的抗体。c-Myc标签应用于Western-blot杂交技术、免疫沉淀和细胞流式术中,可用于检测重组蛋白质在靶细胞中的表达。但需要注意的是Myc标签蛋白本身即为人的Myc基因的一部分,所以在将该蛋白应用于人的细胞或组织相关的实验的时候,应尽量避免。
 文章推荐
文章推荐