
酵母双杂交系统可进行两个蛋白互作分析,可用一个已知的蛋白因子(在双杂交系统中称为诱饵蛋白)去钓取与其结合的蛋白;也可用进一步验证两个蛋白之间的互作。
酵母双杂交实验原理
酵母双杂交系统的建立得力于对真核细胞调控转录起始过程的认识。研究发现,许多真核生物的转录激活因子都是由两个可以分开的、功能上相互独立的结构域(domain)组成的。例如,酵母的转录激活因子GAL4,在N端有一个由147个氨基酸组成的DNA结合域(DNA binding domain,BD),C端有一个由113个氨基酸组成的转录激活域(transcription activation domain,AD)。GAL4分子的DNA结合域可以和上游激活序列(upstream activating sequence,UAS)结合,而转录激活域则能激活UAS下游的基因进行转录。但是,单独的DNA结合域不能激活基因转录,单独的转录激活域也不能激活UAS的下游基因,它们之间只有通过某种方式结合在一起才具有完整的转录激活因子的功能。
酵母双杂交实验步骤
酵母双杂交系统正是利用了GAL4的功能特点,通过两个杂交蛋白在酵母细胞中的相互结合及对报告基因的转录激活来捕获新的蛋白质,其大致步骤为:
1、构建重组Activation Domain(AD)融合的重组质粒(pGADT7载体)以及Binding Domain(BD)融合的重组质粒(pGBKT7载体);
2、双向酵母双杂交实验鉴定蛋白质间的相互作用
2.1 酵母转化中DNA 混合液的配制
在制备酵母感受态的过程中配制下面的DNA 转化混合液(1×):
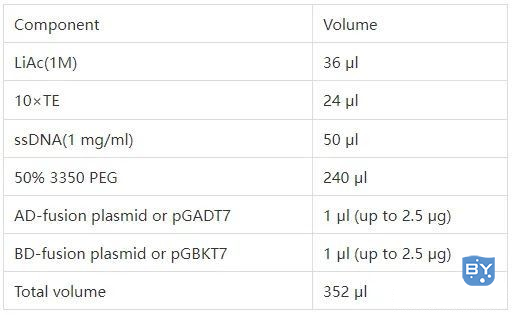
2.2 酵母感受态细胞的制备以及共转化
下面是所需用量为10 个转化实验的酵母感受态细胞的制备。
(1) 挑取平板上AH109 酵母细胞的单个克隆至5 ml YPD 培养基中,30℃
摇床振摇培养过夜(可加入2 mg/ml 的Adenine 75 μl 使酵母生长速度加快);
(2) 转接2.5 ml 过夜培养的菌液至50 ml YPD 培养基中继续培养约3-4 h(OD600~2-4);
(3) 用50 ml 的离心管收菌,4,500 rpm,3 min;弃上清;
(4) 加入20 ml 无菌水洗涤,同样条件离心;弃上清;
(5) 用1 ml 无菌水重悬菌液,转移至1.5 ml 的EP 管中;
(6) 最高速短时离心15 sec;弃上清;
(7) 加入450 μl LiAc (0.1 M) 重悬菌体,30℃摇床振摇培养15 min;
(8) 分装50 μl/管至EP 管中;
(9) 最高速短时离心15 sec;弃上清;
(10) 每管加入已经配制好的DNA 转化混合液(可加入40 μl DMSO 以提高转化效 率),彻底重悬细胞,30℃摇床振摇培养45 min;
(11) 转移至42℃水浴20 min;
(12) 冰上放置3 min;
(13) 最高速短时离心30 sec;弃上清;
(14) 加入100 μl 无菌水重悬菌体,涂布于SCM/-2(缺少色氨酸和亮氨酸的酵母合成培养基)氨基酸缺陷型平板上。30℃恒温箱倒置培养3 天后观察菌落生长情况。

2.3 酵母双杂系统相互作用的筛选
(1) 3 天后,在转化后的平板上各挑取四个单菌落,分别划线于SCM/-2、
SCM/-3 (缺少色氨酸、亮氨酸和组氨酸的酵母合成培养基) 和SCM/-4 (缺少色氨酸、亮氨酸、组氨酸和腺嘌呤的酵母合成培养基)氨基酸缺陷型平板上,30℃恒温箱倒置培养3 天后观察菌落生长情况。
(2) 如果菌落能在SCM/-4 平板上正常生长,说明AD-fusion 和BD-fusion两者之间有强的相互作用;如果不能在SCM-4 平板上正常生长但是能在SCM/-3平板上正常生长,则有弱的相互作用;如果在SCM/-4 和SCM/-3 平板上均不能生长而只能在SCM/-2 平板上生长,则无相互作用。
酵母双杂交实验注意事项
1. 如果诱饵蛋白存在自激活,该如何处理?
该蛋白很可能带有完整的AD区和BD区,是个完整的转录因子,可以将转录因子基因分成两部分分别进行文库筛选,然后重新检测其是否自激活,但要注意切割也有可能破坏蛋白之间的相互作用。
2. 转化效率太低怎么办?
1) 检测感受态细胞效率,标准操作规范。 2) 注意质粒使用量,检查仪器状态。 3) 重新配制新鲜培养基,并做对照转化。
3. 如果诱饵蛋白对酵母细胞是有毒的,该怎么办?
在某些情况下,在液体培养基中培养不好的菌珠可以在固体培养基上生长得很好。首先重悬克隆于 1ml 的 SD/–Trp,接着将重悬液平铺于 5 个 100-mm 的 SD/–Trp 平板,在 30下温浴,直至平板上的克隆相互粘在一起。用 5ml 0.5X YPDA 刮下每块板上的克隆,并收集到一管中,这样就可以使用这个细胞重悬液进行正常的杂交反应。
4. 杂交效率不高,该如何处理?
在杂交中,预转化的诱饵细胞的数量可能不够。当对诱饵菌株进行液体培养过夜时,应挑选大的、新鲜的克隆进行培养,经过离心和重悬后,再使用血球计对细胞进行计数。密度应该在 1 x 109/ml。 一个甚至两个融合蛋白对酵母细胞有毒。你可以通过重组方法来减轻毒性,同时又能保证蛋白的相互作用。或者使用表达水平较低的载体。也可以在琼脂平板或滤膜上进行杂交。但同时必须作杂交对照实验。
 文章推荐
文章推荐