
elisa实验原理
酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)的基本原理是:由于抗原、抗体的反应在一种固相载体——聚苯乙烯微量滴定板的孔中进行,每加入一种试剂孵育后,可通过洗涤除去游离的反应物,从而保证实验结果的特异性与稳定性,且最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅进行定性或定量分析。由于酶的催化效率很高,从而使该测定方法具有高敏感度。具体的方法较多,有用于检测抗体的间接法(图8-1)、用于检测抗原的双抗体夹心法(图8-2)以及用于检测小分子抗原或半抗原的抗原竞争法等等。比较常用的是ELISA双抗体夹心法及ELISA间接法。
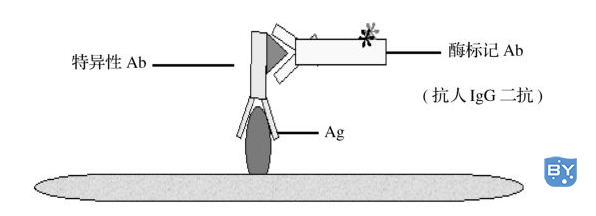
图8-1 ELISA间接法
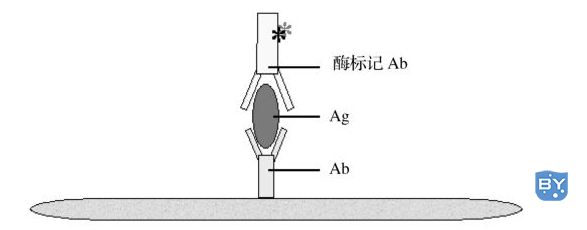
图8-2 ELISA双抗体夹心法
【材料与仪器】
1. 包被缓冲液(pH9.6的0.05mol/L碳酸盐缓冲液)、洗涤缓冲液(pH7.4的0.15mol/LPBS)、底物缓冲液(pH5.0柠檬酸-磷酸氢二钠)、终止液2mol/LH2SO4、抗原、抗体及酶标记抗体、正常人血清和阳性对照血清、TMB。
2. 聚苯乙烯塑料板(简称酶标板)40孔或96孔、ELISA检测仪、50μl、100μl微量加样器、塑料滴头、小毛巾、洗涤瓶、小烧杯、玻璃棒、试管、吸管、量筒等。
3.4℃冰箱、37℃孵育箱。
【实验方法】
一、ELISA间接法间接法是检测抗体最常用的方法,其原理为:利用酶标记的抗抗体检测已与固相结合的受检抗体,故称为间接法。
1. 包被固相抗原:用包被缓冲液将已知抗原稀释至1~10μg/ml,在每个聚苯乙烯板的反应孔中加0.1ml,4℃过夜。次日弃去孔内溶液,用洗涤缓冲液洗3次,每次3min,除去未结合的抗原及杂质。
2.加待检标本:加一定稀释度的待检样品(未知抗体)0.1ml于上述已包被的反应孔中,置37℃孵育1h,用洗涤缓冲液洗3次,每次3min,除去未结合的抗体及杂质。同时做空白孔、阴性对照孔及阳性对照孔。
3.加酶标抗抗体:于反应孔中加入新鲜稀释的酶标第二抗体(羊抗人IgG抗体、鼠抗人IgG抗体等抗抗体)0.1ml37℃孵育30~60min,用洗涤缓冲液洗3次,每次3min,最后一次用DDW洗涤。
4.加底物溶液显色:于各反应孔中加入临时配制的TMB底物溶液0.1ml,37℃10~30min。
5.终止反应:于各反应孔中加入2mol/L硫酸0.05ml。
6.判定结果:直接用肉眼观察结果或在ELISA检测仪上测各孔的od值。本法只要更换不同的固相抗原,可以用一种酶标抗抗体检测各种与抗原相应的抗体。
ELISA双抗体夹心法
双抗体夹心法是检测抗原最常用的方法,操作步骤如下:
1.包被固相抗体:用0.05mol/LpH9.0碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10μg/ml。在每个聚苯乙烯板的反应孔中加0.1ml,4℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3min,除去未结合的抗体及杂质。
2.加待检标本:加一定稀释的待检样品0.1ml于上述已包被之反应孔中,置37℃孵育1h。然后用洗涤缓冲液洗3次,每次3min,除去其他未结合的物质。同时做空白孔、阴性对照孔及阳性对照孔。
3.加酶标抗体:各反应孔中,加入新鲜稀释的酶标抗体0.1ml,37℃孵育0.5~1h,用洗涤缓冲液洗3次,每次3min,除去未结合的酶标抗体。
4.加底物液显色:于各反应孔中加入临时配制的TMB底物溶液0.1ml,37℃10~30min。
5.终止反应:于各反应孔中加入2mol/L硫酸0.05ml。
6.判定结果:直接用肉眼观察结果或在ELISA检测仪上测各孔的od值。根据同样原理,将大分子抗原分别制备固相抗原和酶标抗原结合物,即可用双抗原夹心法测定标本中的抗体。
三、ELISA双位点一步法
在双抗体夹心法测定抗原时,应用针对抗原分子上两个不同抗原决定簇的单克隆抗体分别作为固相抗体和酶标抗体(图8-3),在测定时同时加入标本和酶标抗体,既简化了操作,又缩短了反应时间。如应用高亲和力的单克隆抗体,测定的敏感性和特异性也显著提高。单克隆抗体的应用,使测定抗原的ELISA提高到新水平。

图8-3 ELISA双位点一步法
1. 包被固相抗体:用0.05mol/LpH9.0碳酸盐包被缓冲液将抗体稀释至蛋白质含量为1~10μg/ml。在每个聚苯乙烯板的反应孔中加0.1ml,4℃过夜。次日,弃去孔内溶液,用洗涤缓冲液洗3次,每次3min,除去未结合的抗体及杂质。
2. 加待检标本及酶标抗体:加一定稀释度的待检样品50μl及新鲜稀释的酶标抗体50μl于上述已包被抗体的反应孔中,37℃孵育0.5~1h,用洗涤缓冲液洗3次,每次3min。同时做空白孔、阴性对照孔及阳性对照孔。
3.加底物溶液显色:于各反应孔中加入临时配制的TMB底物溶液0.1ml,37℃10~30min。
4.终止反应:于各反应孔中加入2mol/L硫酸0.05ml。5.判定结果:直接用肉眼观察结果或在ELISA检测仪上测各孔的od值。
【实验结果】
可于白色背景上,直接用肉眼观察结果。反应孔内颜色越深,阳性程度越强,阴性反应为无色或极浅,依据所呈颜色的深浅,以“+”、“-”号表示。也可测od值:在ELISA检测仪上,于450nm(若以AbTS显色,则为410nm)处,以空白对照孔调零后测各孔od值,若大于规定的阴性对照od值的2.1倍,即为阳性。
 文章推荐
文章推荐