
这里把IHC入门的坑都填了
免疫组织化学(Immunohistochemistry, IHC)是免疫染色最常见的应用,其原理是利用抗体与生物组织中的抗原特异性结合从而选择性的识别组织切片细胞中的抗原。IHC广泛用于诊断异常细胞,如在肿瘤中的异常细胞;特定细胞事件的标记,如增殖或细胞死亡(凋亡)。
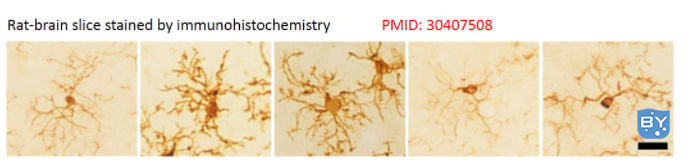
此外,IHC也广泛用于基础研究以了解生物标志物的差异表达以及蛋白质在生物组织的不同部分的分布和定位等。下图是大鼠脑片IHC Iba1染色显示的小胶质细胞的形态:
IHC染色的成功要求阳性反应定位准确,无背景或者浅背景。实际操作中IHC往往不能顺利去预期结果,会出现假阳性或假阴性。今天半夏给大家分享一些IHC中的常见问题及处理方法!
1 阳性对照标本和待测标本均无着色
1. 可能原因分析
1.1 抗体选择不当,不适合做IHC。抗体保存不当,超过有效期或反复冻融导致抗体效价过低或失活。
1.2 抗体工作浓度过低,特别是一抗的浓度过低。同时也有可能是抗体孵育时间过短、温度偏低。
1.3 二抗与一抗种属不匹配,如一抗为鼠源性抗体,二抗没有使用抗鼠的抗体。
1.4 贴片法IHC染色有可能是抗体流失导致切片干燥。
1.5 石蜡切片未进行抗原修复或酶消化等前处理时间过长破坏了待检测抗原决定簇。
1.6 缓冲液PH值不当或含有酶活性抑制剂,如叠氮钠是过氧化物酶活性抑制剂。
1.7 DAB显色时间过短;显色底物不应该含有叠氮钠;在DAB显色时,显色液应该新鲜配制。
1.8 复染、脱水和封片剂的选择与显色系统不匹配。
1.9 阳性对照标本选择不合适,该标本不含有待检测抗原或与所用一抗试剂不匹配。
2. 处理方法
2.1 确认使用抗体的各类抗体试剂的正确保存方法,保证其效价。如果确认抗体已经失效,及时更换。
2.2 检查二抗是否与一抗种属匹配。
2.3 适当提高抗体浓度,优化孵育条件。保证抗体孵育箱温度为37℃,或增加孵育时间,如4℃孵育48小时。
2.4 标本孵育盒平稳放置,防止孵育液流失。
2.5 参考文献选择标本类型适合的蛋白酶消化方法和抗原修复处理方式与条件。
2.6 调节缓冲液至对应正常的PH值,保证不含酶活性抑制剂。
2.7 重新配制DAB显色液,并保证配制方法、浓度、正确、有效,适当延长显色时间。
2.8 选择正确的阳性对照切片。
扩展:
抗体选择有很多方法和网站,在此给大家推荐Citeab,链接为:https://www.citeab.com/ 。
该网站含有来自192个供应商的4512911个抗体,总引用次数高达1914363次。

2
阴性对照标本未着色,而阳性对照标本和待测标本呈弱阳性
1. 可能原因
1.1 标本固定方式不正确,如固定不及时、固定液量太少、固定液失效或组织处理方式不当。
1.2 抗体保存不当,超过有效期或反复冻融导致抗体效价过低或失活。
1.3 抗体浓度太低,特别是一抗的浓度过低,或者抗体孵育时间过短、温度偏低。
1.4 贴片法染色时标本上含有缓冲液,导致抗体浓度稀释。
1.5 未进行抗原修复或酶消化等前处理时间过长破坏了待检测抗原决定簇。
1.6 显色底物配制不正确或不是新鲜配制。
1.7 标本显色时间太短或检测采用HRP标记的反应时显色底物溶液中含有抑制HRP活性的叠氮钠。
1.8 缓冲液PH值不当或含有酶活性抑制剂,如叠氮钠是过氧化物酶活性抑制剂。
1.9 复染、脱水和封片剂的选择与显色系统不匹配。
1.10 待测标本中抗原表达较少。
2. 处理方法
2.1 严格按照IHC标本的取材、固定和处理方法进行。
2.2 确认使用抗体的各类抗体试剂的正确保存方法,保证其效价。如果确认抗体已经失效,及时更换。
2.3 适当提高抗体浓度,优化孵育条件,延长孵育时间。
2.4 洗涤切片最后一次洗涤时尽量去除切片上的缓冲液,以免稀释加入的抗体。
2.5 选择标本适合的蛋白酶消化方法和抗原修复处理方式与条件。
2.6 调节缓冲液至对应正常的PH值,保证不含酶活性抑制剂。
2.7 重新配制DAB显色液,并保证配制方法、浓度、正确、有效,适当延长显色时间。
2.8 保证复染、脱水和封片剂的选择与显色系统匹配。
2.9 将切片上加入0.5%硫酸亚铜溶液孵育5分钟,蒸馏水冲洗后苏木素复染,增加色彩对比度。
3 标本染色太深或整个切片均出现显色
1. 可能原因
1.1 抗体浓度太高,或延长孵育时间过长、孵育温度过高(超过37℃)。
1.2 显色液浓度过高,显色时间太长。
1.3 未正确封闭标本中非特异性结合位点或正常血清孵育时间太短。
1.4 抗体孵育后洗涤次数太少或时间不够。
1.5 未采用高浓度过氧化氢阻断内源性过氧化物酶或过氧化氢失效。
2. 处理方法
2.1 适当对抗体进行稀释,优化孵育时间,控制孵育箱温度。
2.2 重新配制适合浓度的显色液并在显微镜下严格控制显色时间。
2.3 对标本进行正确封闭,延长正常血清孵育时间。
2.4 保证洗涤的时间与次数。
2.5 如过氧化氢失效需更换新的。
4 所有标本包括阴性对照均呈弱阳性反应
1. 可能原因
1.1 染色过程中切片发生干涸。
1.2 抗体浓度太高,或延长孵育时间过长、孵育温度过高。
1.3 缓冲液配制不当或洗涤不彻底。
1.4 显色液配制不当,如过氧化氢浓度过高,显色反应过快,显色反应时间过长。
1.5 载玻片上涂布的黏附剂过厚。
2. 处理方法
2.1 抗体与孵育液需足量,且标本放置在专用的湿盒内,防止染色过程中切片发生干涸。
2.2 重新确定抗体稀释浓度,优化孵育时间,控制孵育箱温度。
2.3 重新配置缓冲液,各步孵育后进行充分洗涤。
2.4 新鲜配制适合浓度的显色液并在显微镜下严格控制显色时间。
2.5 粘片剂的配制浓度和载玻片的处理要规范。
5 所有切片均出现非特异性的背景着色
1. 可能原因
1.1 未有效阻断内源性酶或封闭生物素,也别是对于内源性酶和生物素丰富的组织,如肝脏、肾脏等。
1.2 未选择正确的血清封闭或封闭时间过短。
1.3 抗体不纯或抗体特异性不够。
1.4 抗体浓度太高,或延长孵育时间过长、孵育温度过高。
1.5 显色液配制不当,如过氧化氢浓度过高,显色反应过快,显色反应时间过长。
1.6 组织切片内出血坏死成分太多。
1.7 切片或细胞涂片太厚。
1.8 洗涤液缓冲盐浓度较低,标本漂洗次数不够,时间短。
2. 处理方法
2.1 灭活内源性酶和饱和内源性生物素。
2.2 重新配制封闭血清,封闭时间适当延长。
2.3 重新配制缓冲液。在缓冲液中加入20%的吐温-20可以有效降低背景。
2.4 选择高纯度、高效价的单克隆抗体。进行抗原修复。
2.5 重新确定合适的抗体稀释浓度,并优化抗原孵育时间和温度。
2.6 新鲜配制适合浓度的显色液并在显微镜下严格控制显色时间。
2.7 二抗与标本的内源性组织蛋白存在交叉反应时应该进行更换。
2.8 取材时尽可能避免出血或坏死区域。
6 标本杂质较多
1. 可能原因
1.1 缓冲液洗涤时间和次数不够,洗涤不彻底。
1.2 DAB显色溶液已经过期,存在析出沉淀。
1.3 透明用的二甲苯太脏,未及时更换。
1.4 多甲或福尔马林固定时间太长,已产生福尔马林色素。
1.5 复染试剂放置时间太长,存在析出沉淀。
2. 处理方法
2.1 各步骤之间洗涤需彻底。
2.2 更换显色溶液,并在使用前过滤。
2.3 更换新鲜、干净的二甲苯。
2.4 固定时间不宜过长(小于24小时)。
2.5 过滤复杂试剂或重新配制。
7 待检测切片着色不均
1. 可能原因
1.1 脱蜡不干净。
1.2 抗体或显色液使用太少,没有完全覆盖切片或部分切片已经干涸。
1.3 显色剂使用前未过滤。
1.4 孵育盒放置平台不水平,引起切片倾斜,导致孵育液流失。
1.5 抗体稀释没有混匀。
2. 处理方法
2.1 充分脱蜡。
2.2 保证加入足够量的抗体或孵育液(试组织切片的大小而定),避免标本孵育不完全或干燥。
2.3 显色液临用前配制,用前过滤,避免局部出现不均匀或干燥。
2.4 孵育盒放置水平,防止孵育液流失。
2.5 抗体或孵育液配置时应该充分混匀。
今天给大家分享IHC中的常见问题及处理方法就到此为止了,希望对大家有所帮助!祝大家都能做出完美的IHC图片,多发文章!
 文章推荐
文章推荐