
免疫沉淀(Immunoprecipitation, IP)
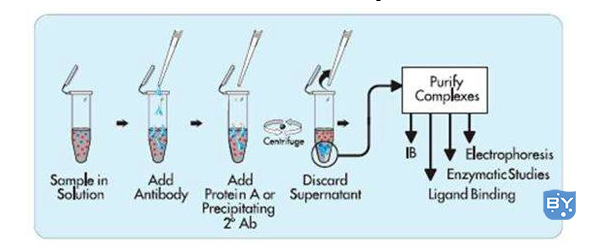
IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法目前多用protein A/G预先结合在argarosebeads上,与使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G 就能达到吸附抗原的目的。通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。免疫沉淀实验从:蛋白样品处理;抗体-agarose beads 孵育;抗体agarose beads 复合物洗涤到最后的鉴定,每步都非常关键,需要严格控制实验流程中每个关键步骤的质量,才能最终达到你的实验目的。
IP 实验步骤
基本实验步骤:
(1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min,12000g离心30min后取上清;
(2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50μlproteinA/G-beads 加入到细胞裂解液,4°C 缓慢摇晃孵育过夜;
(3)免疫沉淀反应后,在4°C以3000g速度离心5min,将proteinA/G-beads离心至管底;将上清小心吸去proteinA/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl的2×SDS 加样缓冲液,沸水煮10分钟(4)SDS-PAGE, Western blotting或进行质谱分析。
一、样品处理:
免疫沉淀实验成功与否,第一步处理样品非常关键。免疫沉淀实验本质上是处于天然构像状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原是否处于天然构像状态。所以制备高质量的样品以用于后续的抗体-agarose beads 孵育对免疫沉淀实验是否成功非常关键。在这个环节中,除了要控制所有操作尽量在冰上或者4°完成外,最为关键的是裂解液的成分。用于免疫沉淀实验的样品一般是原代培养细胞裂解液或者细胞系裂解液。我们以常用的RIPA裂解液为例(主要含有pH7.4 左右的离子缓冲液,接近生理浓度下的NaCl,一定比例的去垢剂和甘油以及各类蛋白酶抑制剂等)来说明其各主要成分的用途,进而帮助我们如何针对不同的实验目的和不同的蛋白质特性来选择最佳的裂解液。
①缓冲液:离子缓冲液常采用pH7.4的Hepes或者Tris-Cl;
②NaCl浓度一般习惯用150mM,这主要是因为150mM接近生理浓度,不会破坏蛋白质之间的相互作用。然而细胞内部的NaCl浓度并不是均一的,局部NaCl的浓度可以低到50mM,150mM的NaCl有可能会破坏这个区域的蛋白质相互作用。因此裂解液配方最佳的NaCl浓度要时所分析的蛋白的亚细胞定位而定;
③蛋白质之间的相互作用;
④裂解液中的去垢剂可以裂解细胞质膜,也同时破坏了许多细胞器的膜,从而释放了其中储存的许多蛋白酶。而由于用于免疫沉淀实验的去垢剂作用比较温和,因此蛋白酶的活性大部分得以保存。还有一部分蛋白酶来自胞质中,主要由于其抑制蛋白或者其活性抑制环境受到改变后从而恢复了蛋白酶活性。因此,添加蛋白酶抑制剂对于防止目的蛋白的降解从而完成免疫沉淀实验非常关键。一般主要通过添加EDTA抑制金属蛋白酶,通过Protease Cocktail(多种蛋白酶抑制剂混合物)可以抑制蛋白酶;
⑤去垢剂对于免疫沉淀实验尤其是免疫共沉淀实验是一个非常关键的因素。不同的去垢剂种类和不同的去垢剂浓度主要通过影响以下三个因素来影响免疫沉淀效果:
a.细胞质/器膜的通透性:因为许多目的蛋白都定位在细胞器中,所以必须先将这些蛋白释放出来,抗体才能与之反应。
b.膜蛋白的释放:许多膜蛋白的构象对去垢剂种类和浓度非常敏感,因此针对这类蛋白的免疫沉淀实验,需要谨慎地尝试多种去垢剂以及不同浓度。
c.蛋白相互作用:不同去垢剂对不同性质的蛋白质的相互作用影响程度不一样,需要根据具体蛋白的特性进行分析选择去垢剂种类和浓度。而由于何种去垢剂适应作用于何种蛋白质现在很难精准预测,所以一个更为切实可行的办法就是通过具体实验筛选合适的去垢剂种类和浓度。
二、抗体-agarose beads 孵育
裂解细胞,离心并去除不可溶的膜组分后,上清可以储存在-80°保存3个月,但最好能够使用新鲜制备的细胞裂解液上清去进行抗体agarose beads 孵育实验。抗体可以先加入上清中与样品孵育数小时后再加入Protein A或者G beads孵育过夜,也可以同时加入抗体和Protein A或者G beads孵育过夜。一般选择1mg 总蛋白(1mg/ml)对应添加1ug抗体,最高可以添加至5ug抗体,过多的抗体会产生假阳性。这个步骤中关键因素在于选择合适的阴性对照。一般选用加同样量的IgG,但更为妥当的方法是选择针对胞内其他无关目的蛋白的一抗做对照。例如,做膜蛋白A的免疫沉淀,选择膜蛋白B来做阴性对照,只要确认二者之间没有相互作用;而做胞质可溶性蛋白C的免疫沉淀,则选择另外一个可溶性蛋白D来做阴性对照,同时,为避免Protein A或Gbeads有(非)特异性吸附从而造成免疫沉淀实验结果的假阳性,一般在加入目的蛋白抗体之前,预先将Protein A或者G beads与细胞裂解液孵育数小时,然后取上清用于后续的抗体-agarose beads孵育。同时,ProteinA或者Gbeads 对不同类型的抗体亲和力不同,结合一抗的种属和Ig亚型,选择合适的Protein A或者G beads也是决定免疫沉淀实验成功与否的一个重要因素。一般推荐使用Protein A和Protein G beads的混合物,这样可以达到最佳实验效果,而且省去了许多选择的烦恼。
三、抗体-agarose beads 复合物洗涤
除了选择特异性好的抗体以及选择合适的阴性对照外,去除免疫沉淀实验非特异性的一个办法是对agarosebeads复合物进行多次洗涤。一般洗涤缓冲液使用和裂解液一样的配方,但去除甘油,以减少由于甘油的粘性带来的非特异性吸附。针对不同的实验要求,还可以通过更改NaCl的浓度以及去垢剂的比例,种类来达到去除非特异性吸附的效果。例如,针对单纯的免疫沉淀而非免疫共沉淀实验或者虽然是进行免疫共沉淀实验,但蛋白质之间的结合比较牢靠,可以考虑使用低浓度(0.2-0.5%)的SDS洗涤抗体-agarose beads复合物,这样可以去除绝大部分非特异性相互作用。
四、鉴定
免疫沉淀实验用途非常广泛,而且基于最基本的免疫沉淀实验衍生出了许多免疫沉淀相关实验手段(比如免疫共沉淀,染色质免疫沉淀和RNA-蛋白免疫沉淀),因此,免疫沉淀实验的鉴定方法主要视实验目的而定。我们在本次主要简单概述常见的免疫沉淀之后的WB检测需要注意的实验环节。由于免疫沉淀实验使用目的蛋白抗体加Protein A/G beads与样品孵育,因此在最后离心获得agarosebeads复合物后,eppendorf 管中主要含有抗体,目的蛋白,Protein A/G beads以及一些其他非特异性作用蛋白。其中,抗体和目的蛋白以及Protein A/G beads三者之间是以非共价键结合在一起,只有Protein A/Gagarose与beads是共价结合在一起的。因此,最后经过添加含巯基乙醇的加样缓冲液以及煮沸变性并离心出去Protein A/G beads后,eppendorf管只有抗体和目的蛋白以及少量非特异性吸附蛋白。这样SDS-PAGE 中就含有目的蛋白和抗体两种蛋白,由于加样缓冲液中含有巯基乙醇从而导致抗体的重链与轻链之间的二硫键被破坏从而使得抗体分子变成重链分子(55KD)和轻链分子(25KD)。因此,WB显色反应中除了能检测到目的蛋白外,如果所使用的二抗与用于免疫沉淀实验的抗体分子属于同一种属的话,还能检测到重链和轻链分子。通常用于免疫沉淀的抗体量非常大(1ug),所以当目的蛋白的大小接近重链或者轻链分时,重链或者轻链分子的WB 信号常常由于信号过强而导致影响对目的蛋白的WB结果判断。针对上述情况,通常有两种解决办法:
①选择不同种属的抗体分别进行免疫沉淀实验和WB实验,这样再选择一个种属交叉反应比较弱或者无种属交叉反应的二抗进行WB实验就可以大大减弱重链和轻链分子的WB信号。
②使用交联剂将抗体和Protein A/G beads交联,然后通过添加不含巯基乙醇的加样缓冲液处理目的蛋白-抗体-agarose beads复合物,最后离心去除抗体agarose beads复合物,上清中只留下目的蛋白。
免疫共沉淀
免疫共沉淀(Co-Immunoprecipitation)是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。是确定两种蛋白质在完整细胞内生理性相互作用的有效方法。其原理是:当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质,蛋白质间的相互作用被保留了下来。如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。这种方法常用于测定两种目标蛋白质是否在体内结合;也可用于确定一种特定蛋白质的新的作用搭档。
其优点为:(1)相互作用的蛋白质都是经翻译后修饰的,处于天然状态;(2)蛋白的相互作用是在自然状态下进行的,可以避免人为的影响;(3)可以分离得到天然状态的相互作用蛋白复合物。
其缺点为: (1)可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用;(2)两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;(3)必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。
实验流程为:
(1)转染后24-48h可收获细胞,加入适量细胞裂解缓冲液(含蛋白酶抑制剂),冰上裂解30min, 细胞裂解液于4°C,最大转速离心30 min 后取上清;
(2)取少量裂解液以备Western blot分析,剩余裂解液加1μg相应的抗体加入到细胞裂解液,4°C缓慢摇晃孵育过夜;
(3)取10μlprotein A琼脂糖珠,用适量裂解缓冲液洗3次,每3000 rpm离心3min;
(4)将预处理过的10μlprotein A琼脂糖珠加入到和抗体孵育过夜的细胞裂解液中4°C缓慢摇晃孵育2-4h,使抗体与proteinA琼脂糖珠偶连;
(5)免疫沉淀反应后,在4°C 以3000rpm 速度离心3min,将琼脂糖珠离心至管底;将上清小心吸去,琼脂糖珠用1ml裂解缓冲液洗3-4次;最后加入15μl的2× SDS上样缓冲液,沸水煮5分钟;
(6)SDS-PAGE,Western blotting 或质谱仪分析。
注意的问题:
(1)细胞裂解采用温和的裂解条件,不能破坏细胞内存在的所有蛋白质-蛋白质相互作用,多采用非离子变性剂(NP40 或Triton X-100)。每种细胞的裂解条件是不一样的,通过经验确定。不能用高浓度的变性剂(0.2%SDS),细胞裂解液中要加各种酶抑制剂,如商品化的cocktailer。
(2)使用明确的抗体,可以将几种抗体共同使用
(3)使用对照抗体:
单克隆抗体:正常小鼠的IgG或另一类单抗
兔多克隆抗体:正常兔IgG
在免疫共沉淀实验中要保证实验结果的真实性,应注意以下几点:
(1) 确保共沉淀的蛋白是由所加入的抗体沉淀得到的,而并非外源非特异蛋白,单克隆抗体的使用有助于避免污染的发生;
(2) 要确保抗体的特异性,即在不表达抗原的细胞溶解物中添加抗体后不会引起共沉淀;
(3) 确定蛋白间的相互作用是发生在细胞中,而不是由于细胞的溶解才发生的,这需要进行蛋白质的定位来确定。ChIP是个很郁闷的实验,时间花费很长,如果做得不好非常打击人,所以实验前心态要调整好,要有耐心!
⑴ 显然抗体来源要可靠,很多在WB上很好的商业化抗体并不能成功使用到ChIP上。
⑵ 超声处理要充分,处理完呢以后DNA一定要跑胶检测看看,如果片段都很大,结果受到的影响很大,特别是如果ChIP组蛋白。
 文章推荐
文章推荐