
No.1 蛋白质定量分析
蛋白质的定量分析是生物化学和其他生命学科最常涉及的分析内容,是临床上诊断疾病及检查康复情况的重要指标,也是许多生物制品,药物、食品质量检测的重要指标。在生化实验中,对样品中的蛋白质进行准确可靠的定量分析,则是经常进行的一项非常重要的工作。
蛋白质种类很多,结构不均一,分子量又相差很大,这样就给建立一个理想而又通用的蛋白质定量分析的方法带来了许多具体的困难。目前测定蛋白质含量的方法有很多种,根据测量方法不同可分为下列几种。
◆ 物理:紫外分光光度法
◆ 化学:凯氏定氮法、Folin-酚试剂法(Lowry法)、BCA法
◆ 染色或荧光:考马斯亮蓝法(Bradford法)、银染法、荧光染料
No.2 常见四种方法
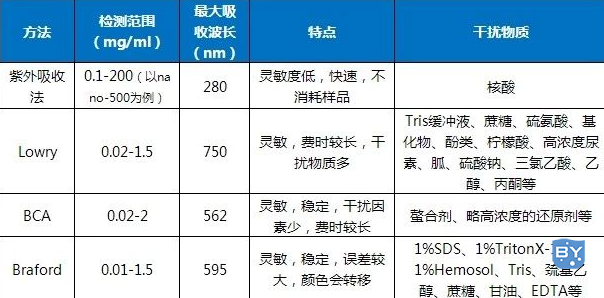
蛋白浓度测定的方法有很多,但每种方法都有其特点和局限性,因而需要在了解各种方法的基础上根据不同情况选用恰当的方法,以满足不同的要求。例如凯氏定氮法结果最精确,但操作复杂,用于大批量样品的测试则不太合适;Lowry法精确度较高,但是比较费时,且每步的时间要求相对严格;Bradford法灵敏简便,但易受去垢剂的影响;BCA法以其试剂稳定,抗干扰能力强,结果稳定,灵敏度高而受欢迎。
在蛋白浓度测定中,以下面四种方法最为常见:
下面主要对lowry法,braford法,BCA法,紫外分光光度法,这几种常用方法进行介绍:
一:lowry法
其原理是蛋白中含有酚基的络氨酸,可与酚试剂中的磷钼钨酸作用产生蓝色化合物,其最大吸收波长为750nm,蛋白含量与750nm的吸光度成正比。
该方法的特点是灵敏度高,反应约在15分钟有最大显色,并最少可稳定几个小时,不足之处是实验过程中需精准控制试剂加入时间,干扰因素较多(如上表)。
二:BCA法
碱性条件下,Cu2+被蛋白还原成Cu+,与BCA试剂形成蓝紫色的络合物,在562nm处具有最大吸收峰,在一定范围内,蛋白含量与562nm的吸光度成正比。
该方法灵敏度高,操作简单,试剂及其形成的颜色复合物稳定,受干扰物影响较少,其优点是不受去垢剂的影响,可兼容样品中高达5%的SDS,5%的TritonX-100,5%的Tween20,60,80。但会受螯合剂和略高浓度的还原剂的影响。
三:Bradford法
考马斯亮蓝G250,在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质—色素结合物在595nm波长下有最大光吸收。在一定范围内,其光吸收值与蛋白质含量成正比。
Bradford法灵敏度高,可检测到微量蛋白,操作简便、快速,重复性好,但常用的试剂会对结果有不同程度的干扰,其中Tris、巯基乙醇、蔗糖、甘油、EDTA及少量去垢剂有较小影响,而1%SDS、1%TritonX-100及1%Hemosol的干扰严重。且显色结果受时间和温度的影响较大,须注意保证样品与标准的测定控制在同一条件下进行。
四:分光光度计法
受蛋白质中络氨酸、色氨酸残基影响,蛋白质溶液在280nm附近有强烈的吸收。若蛋白溶液中杂有的核酸,对测定结果会有较大影响,而核酸最大吸收峰在260nm。所以同时测定280nm及260nm两种波长的吸光度,通过计算可得较为正确的蛋白含量。
该方法测定不需要任何试剂,操作简单,且样品可回收。但在使用公式计算时也应该注意各种蛋白和各种核酸在280nm及260nm处的吸光值也不尽相同,故计算结果有误差。
No.3 总结
综上所述,这几种方法都可用于蛋白质的定量分析,但是每种方法的优缺点各不相同,还是需要结合实验的实际情况选择最合适的方法。
 文章推荐
文章推荐