
关于实时荧光定量PCR技术,最常见的应用是通过RT-qPCR进行基因表达分析、疾病诊断和管理(如病毒定量)、食品检测(如转基因或过敏原分析)以及动物或植物育种等研究。这种方法非常灵敏,因此为了得到可靠的实验数据,避免错误是十分重要的。RT和qPCR数据评估的整个工作流程包括以下几点:
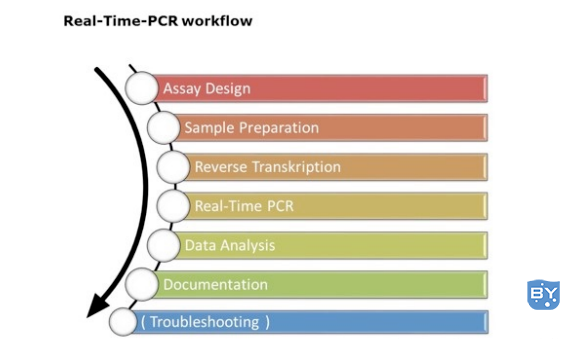
1、实验设计
2、样品的制备和提取/纯化
3、RT和qPCR
4、数据评估
在以上过程中,实验人员有可能因为操作错误或失误导致实验数据的失真。但往往有些错误的来源又十分不明确,所以排除故障的第一步是需要再次检查实验流程并重复实验。
实验设计
RT或qPCR反应的第一个重要步骤是测定PCR产物及验证相应的引物和探针。实时RT-qPCR引物和探针最有效的设计是使用引物设计软件,大多数软件都可以调整设置参数的最佳属性,以检索到符合要求的引物探针序列。这些设置参数考虑熔化温度Tm、互补性、二级结构以及扩增子大小和其他重要因素。同时建议跨内含子设计引物,避免来自gDNA的干扰,直接得到cDNA片段。对于基因特异性引物的设计,应满足以下标准:
扩增子大小: 75-200 bp
引物长度: 18-30 bp
GC 含量: 40-60%
解链温度: 55-60℃
3' 端: 1-2 G or C,以具有良好的稳定性
不超过3个G or C (可能不匹配)
没有二级结构,重复序列或回文结构
浓度: 150-200 nM
样品的制备和提取/纯化
模板的质量直接影响到检测性能,在qPCR结果的故障排除过程中也需要考虑。首先,组织取样和保存是实验可变性的第一个潜在来源。对于基因的定量,必须使用高质量的RNA,这意味着需要非常仔细地检查RNA的浓度和质量。
降解或不纯的RNA会限制逆转录反应的效率,降低产量;部分降解的RNA可能不能给出准确的基因表达结果。核酸应从新鲜或立即冷冻的组织中提取和纯化;同时建议使用生物学重复(至少3个)。RNA或DNA的分离是PCR实验前的关键步骤。这是必要的,以便提取对所有样本都是有效的,并得到纯化的核酸(DNA,RNA)。可采用高分辨率琼脂糖凝胶检测核酸质量和分光光度法(A260/A280=1.8和A260/A230=2.0)检测核酸纯度。
另外也要注意,用于PCR制备的工作空间所有台面及物品都应进行常规去污,以防止交叉污染。
逆转录和实时荧光定量PCR
RT-qPCR是一种分析DNA或RNA的高灵敏性工具。当PCR扩增靶标时,错误同时被放大。可以通过标准化和尽量减少移液步骤来减少PCR反应中的技术错误;在无灰尘的干净环境中建立反应;通过对无模板(水)对照进行PCR反应,常规检查引物和试剂库存的DNA污染等。
在进行qPCR时可能会出现以下故障:没有扩增、qPCR效率多大或过小、Cq值过大、重复性差、扩增曲线异常、非特异性扩增等等。遇到这些问题应该怎么解决呢,查看以下文章,问题迎刃而解:
运行后的数据分析-基线和阈值的设置
基线校正是去除背景荧光的必要条件。可能的原因是qPCR设备的检测器噪音,或是不同的样品量或染料(探针或插入染料)的残留荧光。所有样本的基线起点一般从0~3个循环开始进行量化,基线终点是在各个扩增曲线起峰位置前的1~2个循环。为了使实时RT-qPCR数据有意义,应在扩增曲线的指数扩增阶段设置阈值,阈值自动设置一般是基线期荧光信号标准偏差的10倍。
 文章推荐
文章推荐