
流式细胞仪是分析细胞和其他成分(如细胞核和染色体)的物理和化学性质的强大工具。但是,如果您是流式细胞仪初学者,整个过程可能会相当混乱。为了获得最好的结果,需要大量的深思熟虑和计划。在这篇博文中,我们通过五个简单的步骤简化了流程,以确保取得成功。
第 1 步:提前计划您的实验
与大多数实验一样,事先仔细计划对产生可重复的结果大有帮助。然而,对于成功的流式细胞术来说,这一点更为重要。为了指导您进行计划,在开始实验之前,您应该仔细考虑以下几个问题:
是否有适用于您的目标蛋白或目标细胞的试剂?
我们建议您首先进行文献检索或使用抗体搜索引擎Citeab,它会针对您的特定目标整理最常引用的抗体。在 Citeab 上,您还可以按应用程序搜索,以确保您为特定应用程序使用正确的克隆。
您的流式细胞仪是否适合您使用的荧光团?
重要的是您首先检查您的细胞仪的配置,以确定您想要使用的荧光团是否有可用的激光。此外,检查每个荧光团的激发和发射光谱以评估溢出,即一个荧光团的荧光溢出到另一个荧光团的检测通道中(请参阅面板设计的更多提示)。使用荧光光谱查看器来协助完成此操作,并尝试选择溢出尽可能少的荧光团。了解预期荧光团的相对亮度也将帮助您选择最佳面板。您可以在我们选择合适的荧光团文章 中找到荧光团亮度图表和更多信息。
细胞生物学和预期的实验结果是什么?
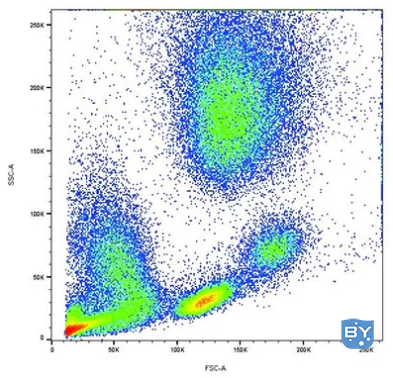
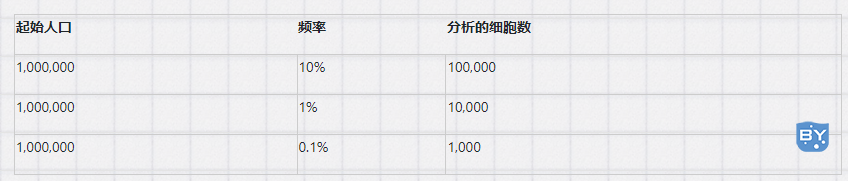
了解实验样本的生物学特性对于流式细胞术结果的成功至关重要。例如,了解您的目标抗原的相对表达将帮助您确定哪个荧光团用于哪个标记。经验法则是对高表达抗原使用较暗的荧光团,对表达较低的抗原使用较亮的荧光团。如果您不确定目标抗原在您的实验条件下的表达,请使用几乎不会溢出到其他通道的荧光团。此外,了解目标细胞的种群密度或频率对于确定要收集的事件数量或开始生成样本以获得有意义的结果至关重要(见下表)。其他需要注意的事情是细胞变化、干扰成分、
第 2 步:仔细准备细胞
既然您已经完成了所有计划,下一步就是仔细准备您的样品。那么,您的起始样本是什么? 根据您的研究问题,流式细胞仪分析中经常使用几种样本类型,每种类型都需要独特的处理。对于每种样品类型,关键是保持细胞活力并产生单细胞悬浮液。对于最常用的样本类型,请考虑以下几点提示:
细胞培养
确定细胞是贴壁细胞还是悬浮细胞,因为这将帮助您决定收集它们进行分析的最仔细的方法。在决定哪种方法适合您时,目标是选择最不苛刻的治疗方法,以提供最佳的生存能力并且不影响细胞功能。例如,胰蛋白酶-EDTA 或 Accutase™ 可用于收获贴壁细胞,但如果您的目标抗原在细胞表面表达,胰蛋白酶可能不理想,因为这种酶会切割细胞表面抗原。细胞刮除也可用于收获贴壁细胞,但这种方法可能会导致细胞活力降低。在制备细胞时,Ca 2+或 Mg 2+应使用游离培养基来避免细胞聚集,因为细胞表面整合素需要这些元素来结合蛋白质和底物,从而增加聚集。
骨髓细胞
收集骨头时,尽量去除肌肉和组织,因为它们会堵塞流式细胞仪,并且还会与抗体非特异性结合。此外,尽量避免在无菌条件下冲洗骨头造成污染。
次级淋巴器官(脾脏、胸腺或淋巴结)
均质化可用于从这些器官中收获细胞,但重要的是不要过度均质化,因为这会导致 DNA 从细胞中释放,从而导致结块。在培养基中添加 EDTA 或 DNase I 有助于控制均质化的结块。然而,对于这些组织,可能需要更温和的技术,例如使用注射器柱塞通过细胞过滤器捣碎。
实体器官
添加酶消化的均质化通常用于固体器官。这会分解细胞外基质,从而释放细胞。因此,使用的酶是组织特异性的,没有它,细胞可能不会从器官中释放出来。小心避免粘性 DNA 的释放和细胞聚集对于从实体器官中收获细胞也很重要。同样,添加 DNase I 或 EDTA 将有助于生成单细胞悬液。
血
在为流式细胞术分析准备血液时,使用适当的抗凝剂至关重要。例如,EDTA 破坏抗原构象,不适合细胞因子的细胞内染色。还应注意,如果您使用 Ficoll™ 分离血液成分,如果您有兴趣研究这种细胞群,您将错过粒细胞。
第 3 步:控制、控制和控制
使用适当的控制设置您的实验对于最终理解您的数据是必要的。它将帮助您确定什么是真正的负面或正面,以及如何设置您的分析之门。计划在您的实验设计中包括以下控制:
未染色
这些细胞没有任何抗体染色,并提供负染色和荧光背景水平的指示。
单染
这些对于设置您的补偿控制是必要的。
未受刺激/完全受刺激
这对于细胞因子释放测定尤为重要,因为它允许您确定实验的动态范围。
已知阴性/阳性
如果您是第一次研究细胞群,这组控件将让您估计预期的结果以及细胞应放置在门中的什么位置。
同型对照
同型对照 的使用颇具争议(如我们的多色流面板对照文章中所讨论的);然而,它们可以帮助估计通过 Fc 受体的非特异性结合以及抗体和荧光团的非特异性表面结合。
荧光减一 (FMO)
这些控件在构建多色面板时很受欢迎,因为它们提供了有关荧光团扩散和交叉激光刺激的信息。
第 4 步:发挥作用 - 充分利用染色
为确保获得最佳染色效果,需要考虑几个因素。以下是在您的抗体染色步骤之前要做的最重要的事情,以改善您的结果:
阻断非特异性结合
由于非特异性结合会显着影响数据分析和结论,因此在缓冲液中添加血清(如 BSA 或 FCS)以及在抗体染色之前加入 Fc 阻断步骤将改善您的结果。
抗体滴定
过量的抗体会以低亲和力结合并产生背景,从而影响您的结果。因此,确定特定样品所需的适量抗体非常重要。如果您使用同种型对照,请务必以与您的正确抗体相同的浓度使用它们。为了确定最佳抗体浓度,染色指数(定义为阳性和阴性群体之间的分离率除以阴性群体的标准偏差的两倍)可以作为指导。计算每个测试抗体浓度的染色指数并生成类似于下图的图表(抗体浓度与染色指数)将帮助您确定正确的抗体浓度。在下图中,
污点指数:

第 5 步:去除双峰和死细胞
双峰可以通过在分析中包含误报来显着影响结果的准确性。当细胞通过激光束时,阴性细胞和阳性细胞的双联体将产生与单个阳性细胞相同的荧光,从而导致阴性细胞无意中包含在您的分析中(见下图)。
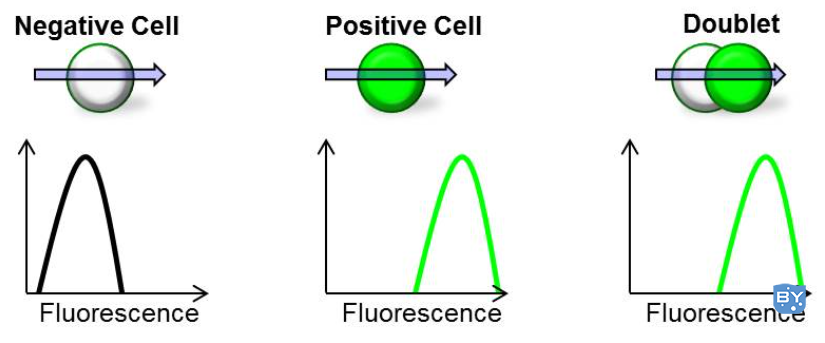
对于免疫表型实验,如果 FITC 阳性细胞粘附在 PE 阳性细胞上,流式细胞仪会记录一个双阳性细胞,这是不准确的。此外,在细胞周期分析中,双峰会歪曲 4n 细胞,导致您得出错误的结论。
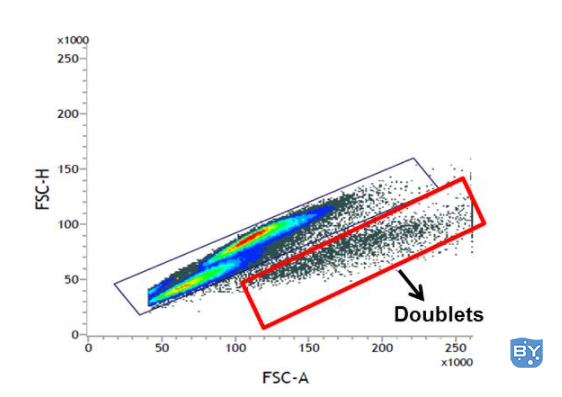
因此,为确保结果的准确性,分析期间应排除双峰。一种方法是使用前向散射高度 (FSC-H) 与前向散射面积 (FSC-A) 方法(见下图)。高度测量表示信号的强度(即目标蛋白的表达),而面积则将信号/蛋白表达与细胞大小相关联。因此,相同大小的单元格通常会在点图上显示非常相似的面积和高度。如下图所示,单峰与双峰和团块分开,并以对角线聚集。因此可以排除双峰,因为它们的面积会异常大。确保在分析之前使用您的细胞而不是珠子在您的流式细胞仪上设置面积缩放功能,以便使用此方法正确排除双峰。
死细胞也会严重影响您的分析。这些细胞是自发荧光的,可通过非特异性结合导致背景增加,并降低动态范围,从而无法识别弱阳性样品。因此,强烈建议您始终在实验设计中包含死细胞标记。仅从分析中排除 FSC/SSC 门底部的细胞碎片是不够的,因为死细胞可能包含在门控样本中。
 文章推荐
文章推荐