
翻译后修饰是指蛋白质合成后氨基酸序列的任何改变。
它可能涉及在蛋白质生物合成后通过共价或酶促方式修饰氨基酸侧链、末端氨基或羧基。
通常,这些修饰会影响蛋白质的结构、稳定性、活性、细胞定位或底物特异性。
翻译后修饰为蛋白质组提供了复杂性,以实现具有有限数量基因的多种功能。
地点
翻译后修饰 (PTM) 主要发生在细胞的内质网中,但有时也会继续存在于高尔基体中。
翻译后处理
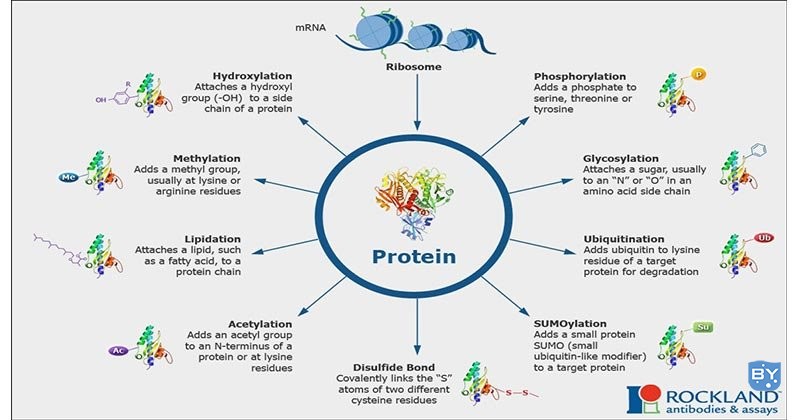
合成完成后,可以通过磷酸化、糖基化、ADP核糖基化、羟基化和添加其他基团等多种方法对蛋白质进行修饰。
蛋白水解
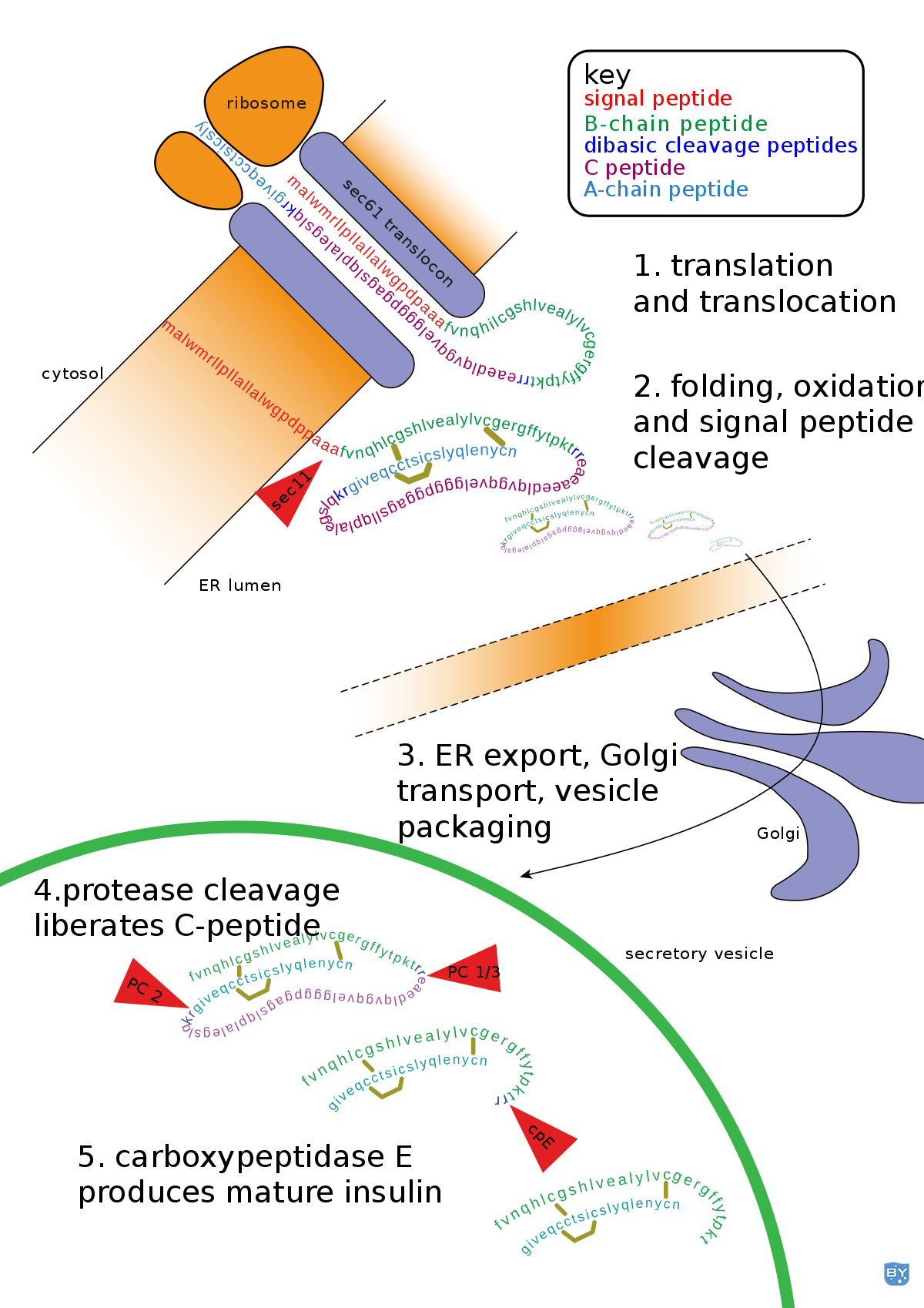
随着新合成的蛋白质在内质网腔中释放,信号肽酶切割肽序列。除信号肽外,蛋白质的一些多肽序列也被切割,形成最终序列。
例子:
胰岛素以无法发挥其功能的非活性形式在细胞中合成。翻译后修饰确保适当的功能,包括去除部分蛋白质以将其转化为三维和完全活性的形式。
磷酸化
磷酸化是向蛋白质添加一个或多个磷酸基团。翻译后磷酸化是动物细胞中最常见的蛋白质修饰之一。大多数磷酸化是作为调节蛋白质生物活性的机制发生的。在动物细胞中,丝氨酸、酪氨酸和苏氨酸是进行磷酸化的氨基酸。
糖基化
糖基化是将碳水化合物分子添加到多肽链中并将其修饰为糖蛋白。许多注定要成为质膜的一部分或从细胞中分泌出来的蛋白质,都具有连接到天冬酰胺的酰胺氮(N 连接)或丝氨酸苏氨酸(O 连接)的羟基上的碳水化合物链。N糖基化发生在ER中,O糖基化发生在高尔基复合体中。
硫酸化
硫酸盐修饰通过添加硫酸盐分子进行,这些蛋白质修饰发生在酪氨酸残基上。酪氨酸硫酸化通过酪氨酰蛋白磺基转移酶 (TPST) 的活性完成,TPST 是跨高尔基网络的膜相关酶。有两种已知的 TPST。TPST-1 TPST-2 通用磷酸盐供体是 3'-磷酸腺苷-5'-磷酸硫酸盐 (PSPA)。
甲基化
单碳甲基转移到氮或氧转移到氨基酸侧链增加了蛋白质的疏水性,并且当与羧酸结合时可以中和氨基酸的负电荷。甲基化由甲基转移酶介导,S-腺苷甲硫氨酸 (SAM) 是主要的甲基供体。
羟基化
向蛋白质氨基酸添加羟基的生物学过程称为羟基化。蛋白质羟基化是一种类型的 PTM,它涉及将 -CH 基团转化为 -COH 基团,这些羟基化氨基酸参与了一些称为转录因子的重要因子的调节。在这20个氨基酸中,用这种方法调节的两个氨基酸是脯氨酸和赖氨酸。
其他
a) SUMO化
SUMO (small ubiquitin related modifier) 蛋白是 100 个氨基酸残基蛋白,它们与靶蛋白的结合方式与泛素相同。它们还赋予蛋白质的转录调节活性并帮助目标蛋白质从细胞质转运到细胞核。
b) 二硫键形成
稳定蛋白质结构并参与氧化还原过程。
c) 脂酰化、乙酰化、异戊二烯化等。
意义
蛋白质是通过核糖体将 mRNA 翻译成多肽链来合成的,然后可以对其进行修饰以形成成熟的蛋白质产物。
不基于基因模板的蛋白质的翻译后修饰可以通过引起蛋白质活性、它们的细胞位置和与其他蛋白质的动态相互作用的变化来调节蛋白质功能。
PTM 具有重要的生物学功能,包括:
有助于正确的蛋白质折叠——很少有称为钙连接蛋白的凝集素分子与糖基化蛋白质结合并协助其折叠。
赋予蛋白质稳定性-糖基化可以通过增加蛋白质半衰期来改变蛋白质的稳定性。
它通过阻断切割位点来保护蛋白质免受蛋白水解酶的切割。
蛋白质分选或易位 - 如果蛋白质中存在磷酸化甘露糖残基,它总是会进入溶酶体。
它调节蛋白质的活性和功能——蛋白质的磷酸化是一种可逆的 PTM,可激活蛋白质。
乙酰化调节许多不同的功能,包括 DNA 识别、蛋白质-蛋白质相互作用和蛋白质稳定性。
蛋白质的氧化还原依赖性 PTM 正在成为通过进化保存的关键信号系统,影响细胞稳态的许多方面。
PTM 是细胞信号传导的重要组成部分,例如当激素原转化为激素时。
它显着增加了蛋白质组的多样性和复杂性。
 文章推荐
文章推荐