
细胞周期是指细胞分裂结束到下一次细胞分裂结束所经历的时间,它代表着生命从一代向下一代传递的连续过程,与前几期我们介绍过的细胞学实验(细胞增殖、克隆形成等)一样,细胞周期也是评价细胞增殖功能的重要实验。流式细胞仪是检测细胞周期最常用的方法,然而我们会碰到细胞量不够、细胞碎片太多等原因,导致实验一次次重复,本文就一起看看如何把细胞周期的数据变的更加漂亮,准确!
一、细胞周期简介
主要分为以下2大过程:
分裂间期:间期又分为三期、即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期);
分裂期M期:细胞分裂期,指细胞分裂开始到结束。
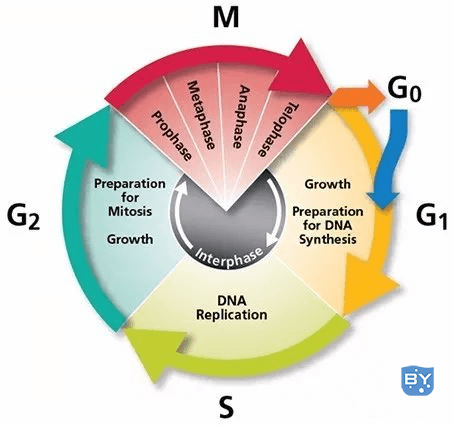
细胞周期图(来自网络)
注:G0期是指某些细胞在分裂结束后会暂时离开细胞周期,停止细胞分裂;但在一定适宜刺激下,又可进入周期;
因为分裂间期持续的时间远远比分裂期持续时间长,在一个正常细胞周期中,分裂间期时间会占整个细胞周期的90%~95%;
不同类型细胞的G1期时间长短不同,所以其细胞周期时间存在差异。如:人类胃上皮细胞为24小时,骨髓细胞为18小时,HeLa细胞为21小时。
二、常用的实验方法
细胞周期常用检测方法有流式检测法、BrdU(5-溴脱氧尿嘧啶核苷)掺入法及同位素标记法等,其中流式检测法因适用于大量样品检测,可快速分析单个细胞的多种特性,是目前最为常用的测定细胞周期的一种方法,下面就详细介绍如何利用流式细胞仪进行周期分析。
1.流式检测的实验原理
由于细胞周期各时相的DNA含量不同,因此,可通过特异性与DNA结合染料来检测细胞内的DNA含量来测定细胞周期。流式中常用碘化丙啶(Propidium,简称PI)与DNA结合,其荧光强度与DNA含量成正比。因此,通过流式细胞仪对细胞内DNA含量进行检测,同时获得的流式直方图对应的各细胞周期可通过特殊软件计算各时相的细胞百分率。
2.流式细胞仪的实验步骤
A.收集细胞取适量的对数生长期细胞接种于6cm中,在相应的条件下(如药物)处理相应时间后,倒去培养基,用胰酶适度消化细胞,离心收集细胞,弃去上清;
Tips:
细胞数量:一般情况下,由于在细胞周期中分析的细胞数应达到1.0*104~3.0*104才具有统计学意义。因此,单次流式细胞仪检测细胞周期时,1份样品的细胞数量至少为106;
细胞培养时间:一般药物等处理时间最好是大于细胞增殖一代的周期,可根据具体细胞分裂时间决定,如乳腺癌细胞我们一般处理24h。
B.清洗及固定细胞用PBS清洗细胞2遍,吸净离心管残余的PBS后,加入300μLPBS重悬,将细胞吹散,避免细胞成团。随后将细胞悬液逐滴滴入700μL无水乙醇(预冷),即用70-75%的乙醇固定细胞,然后4℃固定过夜。
Tips:
由于流式分析时需要的是单个细胞悬液,因此在操作过程中需充分混悬细胞;
细胞固定后,不可过度吹打细胞,以防产生过多的细胞碎片。
C.洗涤细胞次日,离心收集细胞,用移液枪吸走上清,然后用1mLPBS重悬细胞并离心清洗2~3遍。
Tips:
细胞可以长期保管在-20℃,可存放1个月,染色不会受影响;
用PBS重悬细胞时,动作要轻柔。此外,离心速度(1200rpm/min)不要过快以免造成细胞的破裂。
D.RNA酶消化和PI染色在避光条件下,每个样品加入1避光RNase(10mg/mL)和5和mg/m(5mg/mL)混匀后室温避光条孵育30min。
E.上机检测将检测样品转移到5mL的流式管后用流式细胞仪检测细胞周期,采用flowjo或modifit软件进行DNA含量分析。
Tips:
上机检测时,必须重悬成细胞悬液后再检测,否则容易堵仪器管道;
如果细胞过多或聚团严重,可先用300目(孔径40~50微米)尼龙网过滤,然后再上机检测。
3.实验数据分析
常用的流式检测法分析细胞周期的方法是根据细胞DNA含量(横坐标)结合纵坐标的细胞数量来分析的,如下的乳腺癌细胞系T47D细胞周期分布图:
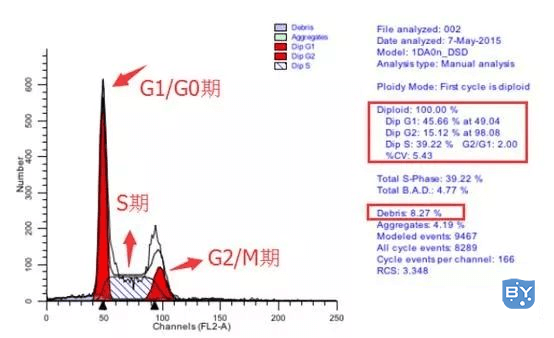
乳腺癌细胞系MCF-7细胞周期分布图
图形区(左侧)
G0/G1期:流式检测结果图的第一个峰;G1期是DNA含量最少的时期,DNA复制还没有开始;G0期是细胞静止期,不复制DNA,无法与G1期分开,所以报告为G0/G1期;
S期:在流式结果图中显示为第二个不高但很宽的峰;此时期细胞开始复制到完成复制,是一个一倍DNA到二倍DNA的过程;
G2/M期:流式检测结果图的第三个峰。G2期是DNA复制完成至分裂的一段时间,此时细胞内含二倍DNA;M期是细胞分裂的过程,此时细胞内是二倍DNA,无法与G2期分开,所以报告为G2/M期。
数据分析区(右侧红方框)
各时期比值:DipG1-45.66%at49.04表示G1期DNA含量平均值为49.04(2N),占细胞总数的45.66%。同理,DipG2-15.12%at98.08则表示G2期DNA含量平均值为98.08(4N),占细胞总数的15.12%。以此类推,可以得知S期和G2/G1期的百分比;
CV:表示峰的变异系数,一般CV越小,峰形越好,越尖锐;能控制在5%左右是比较好的结果,一般小于10%就被认可了。
Debris:表示细胞碎片,越少越好;
其他:Aggregates:表示细胞聚集体;Modeledevents:表示仪器检测到的总细胞数;Allcycleevents:表示在细胞周期中分析的细胞数(即排除了细胞碎片和聚集体)
举例:如常用于研究药物或者基因等对细胞周期阻滞的影响
通过比较Control组和药物组,发现化合物影响乳腺癌细胞系MDA-MB231的细胞周期分布,处理组的G2/M期峰值变高,即G2/M期细胞数量增多,即药将其阻滞在G2/M期。注:对于未处理的细胞一般都是分裂间期时间比分裂期长,即G1-S期>M期。
![药物处理MDA-MB231细胞后的周期分布图[2] 药物处理MDA-MB231细胞后的周期分布图[2]](/static/upload/image/20211125/1637806484146678.png)
药物处理MDA-MB231细胞后的周期分布图[2]
常见问题解答
是否可以直接用70~75%的乙醇固定细胞?
不可以,直接70~75%乙醇加入很容易导致细胞聚团现象,很难重悬成单细胞,影响固定效果,甚至容易导致固定后无细胞沉淀的现象。正确做法是:待细胞充分分散成单细胞后,缓慢地滴入无水乙醇中,使其终浓度为70~75%乙醇。
上机细胞量过少,无法获得数据结果?
首先,要保证收集足够的细胞样品(个人经验至少收集100万左右);如果药物处理后细胞死亡过多,应该降低药物浓度;
其次,固定细胞时先用预冷的PBS重悬细胞,再逐滴滴入无水乙醇中;
细胞清洗时,不可过度吹打细胞,以防产生过多的细胞碎片;
最后,尽量采用尖底的离心管和水平的离心机,离心后尽量用移液枪吸走上清,不要倾倒,残留一点,不要吸完;
什么样的数据结果可以用?
G2/M期细胞的DNA含量是G1期的2倍,在直方图上形成一个2倍于G1信号峰的高斯峰;
CV(变异系数)表示峰的宽度,CV值越小,峰形越好,最好是在5%左右,一般小于10%也被认可。
RCS最好是在1~3,高于5则不被认可。RCS高,说明数据的分布和软件所建立模型的预期值的差别比较大,可能由于处理细胞的时候RNA酶消化不好,或者是PI的浓度不佳造成的。
在实验操作过程中,如何提高G0/G1峰分辨率和精确度?
变异系数(CoefficientofVariation,CV值)反映G0/G1峰分辨率和精确度。而样品CV值为样品固有,与样本制备过程中细胞质量有关。细胞碎片越少、细胞聚团越少、RNA酶消化越充分,可以减少样本的CV值,提高G0/G1峰分辨率和精确度。
 文章推荐
文章推荐