
转染可谓是做生物学实验的大家经常会考虑的一项实验技术,大致原理也都是明白的。但是在实验时经常会遇到转染效率太低,以至于无法进行后续的实验。
到底转染是什么呢?
为什么转染效率不高呢?
其实
转染,就是在真核细胞里导入具有生物功能的核酸,并在细胞中维持其生物功能。
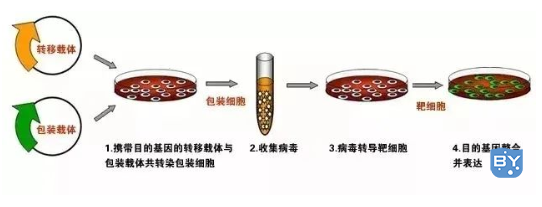
转染方法的选择
我们熟知且常用的转染方法主要有物理介导,化学介导,生物介导。
物理介导方法:电穿孔法、显微注射和基因枪;
化学介导方法:如经典的磷酸钙共沉淀法、脂质体转染方法、和多种阳离子物质介导的技术;
生物介导方法:有较为原始的原生质体转染,和现在比较多见的各种病毒介导的转染技术。
但实验室使用较多的主要有化学介导中的脂质体转染(质粒转染)和生物介导中的慢病毒转染法。其中质粒转染操作简单,一般瞬时转染选择较多,但有些细胞系不容易转染,因此选择转染方式时一定要做足功课,亲身经历告诉我,千万不要图方便,否则转染效率简直崩溃。特别是养原代细胞的小伙伴,一点要认真选择!病毒转染一般具有能够稳定表达的优势,且其对原代细胞有较高的转染效率,其中更分为慢病毒转染,逆转录病毒转染和腺病毒转染,其中腺病毒转染可适合更为难转染的细胞,例如悬浮细胞、T细胞、raw细胞等难转染细胞。
转染的注意事项
01
有血清时的转染
血清一度曾被认为会降低转染效率,但只要在DNA-阳离子脂质体复合物形成时不含血清,在转染过程中是可以使用血清的。
转染过程在两步中需要使用培养基做为稀释液:在DNA-阳离子脂质体复合物准备过程以及复合物同细胞接触过程。
在开始准备DNA和阳离子脂质体试剂稀释液时要使用无血清的培养基,因为血清会影响复合物的形成。但在复合物形成后,在加入细胞中前可以加入血清。
阳离子脂质体和DNA的最佳量在使用血清时会有所不同,因此如果你想在转染培养基中加入血清需要对条件进行优化。
大部分细胞可以在无血清培养基中几个小时内保持健康。对于对血清缺乏比较敏感的细胞,可以使用一些营养丰富的无血清培养基,或者在转染培养基中使用血清。
对于对血清缺乏比较敏感的贴壁细胞,建议使用LIPOFECTAMINE 2000。
02
培养基中的抗生素
抗生素,比如青霉素和链霉素,是影响转染的培养基添加物。
这些抗生素一般对于真核细胞无毒,但阳离子脂质体试剂增加了细胞的通透性,使抗生素可以进入细胞。这降低了细胞的活性,导致转染效率低。所以,在转染培养基中不能使用抗生素,甚至在准备转染前进行细胞铺板时也要避免使用抗生素。这样,在转染前也不必润洗细胞。
对于稳定转染,不要在选择性培养基中使用青霉素和链霉素,因为这些抗生素是GENETICIN选择性抗生素的竞争性抑制剂。另外,为了保证无血清培养基中细胞的健康生长,使用比含血清培养基更少的抗生素量。
大多数已建立的细胞系都是非整倍体,原代培养包括了表达不同基因组合的细胞的混合物。细胞培养在实验室中保存数月和数年后会经历突变,总染色体重组或基因调控变化等而演化,这会导致和转染相关的细胞行为的变化。如果随时间发现这种变化,融化一管新鲜的细胞可能会恢复原先的转染活性。比如,新鲜融化的NIH 3T3细胞比传代8次的细胞表现出更高的转染效率,融化细胞的进一步传代并没有降低转染效率。因此,如果观察到转染效率降低,可以试着转染新鲜培养的细胞以恢复最佳结果。
03
细胞状态
众所周知,细胞的生长状态影响实验结果,原代细胞和传代次数多的细胞都不是最佳选择,处于对数生长期的细胞生长状态最好,最适合转染。
同时,我们都知道细胞的密度不宜过大,大家往往注意的都是转染前的密度,失败过很多次的经历告诉大家,转染后的细胞密度更加重要。
有时候转染时间太久,等到进行后续实验时细胞已经肆意生长,漂起来了,岂不前功尽弃,流着眼泪也要告诉大家,考虑好细胞的生长周期和转染的时间进行铺板,建议选择50%~80%区间密度进行细胞转染。
04
细胞铺板密度
用于转染的最佳细胞密度根据不同的细胞类型或应用而异。
一般转染时,贴壁细胞密度为70%-90%,悬浮细胞密度为2×106-4×106细胞/ml时效果较好。确保转染时细胞没有长满或处于静止期。因为转染效率对细胞密度很敏感,所以在不同实验间保持一个基本的传代步骤很重要。
铺板细胞数目的增加可以增加转染活性和细胞产量。在三种不同密度进行细胞铺板的比较表明铺板密度最高的,CAT活性也最高。得到最高活性所需的LIPOFECTAMINE试剂的量也相应增加了。这些结果说明,对于转染相同量的DNA所需的最佳阳离子脂质体试剂的量会因细胞密度而异。
05
启动子的选择
获得高转染活性所需选择的启动子依赖于选用的细胞系和要表达的蛋白。
CMV启动子在大多数细胞类型中可以获得高表达活性,同其他启动子,如SV40和RSV(劳斯肉瘤病毒)相比,在BHK-21中其活性最高。
这三种病毒启动子在T细胞来源的细胞系,如Jurkat中组成表达水平较低。转染后在培养基中加入PHA-L和PMA可以激活Jurkat细胞中CMV启动子,而单PMA就足以激活KG1和K562(人骨髓瘤白细胞)中的CMV启动子。
SV40启动子的表达在含有大T抗原(存在于COS-1和COS-7)时会提高,因为大T抗原可以刺激染色体外的合成。
06
DNA量
高质量的DNA对于进行高效的转染至关重要。以前研究者使用CsCl梯度离心得到的DNA进行转染,但是这种方法费时费力。
其他的质粒纯化技术如Marligen的High Purity Plasmid Purification System使用独特的阴离子交换树脂纯化DNA,可以得到用于转染的高质量DNA。
另外,Marligen的纯化系统实验步骤很简单,可以在2小时内完成。
07
瞬时和稳定表达
DNA转染后,转入基因的表达可以在1-4天内检测到。仅有一部分转入细胞的DNA被转运到细胞核内进行转录并最终输出mRNA到细胞质进行蛋白合成。几天内,大部分外源DNA会被核酸酶降解或随细胞分裂而稀释;一周后就检测不到其存在了。
瞬时表达分析检测未重组质粒DNA上基因的表达。因此,表达水平与位臵无关,不会受到周围染色体元件的影响。瞬时表达分析所需的人力和时间比稳定表达少,但因为DNA摄入效率和表达水平在不同实验中差异较大,实验必须很小心。
为了进行稳定表达,转入的基因必须能和细胞同步复制。在转染的质粒自发整合到宿主基因组上时就会如此。在一小部分转染的细胞中,加入的DNA通过重组整合到基因组上。包含整合DNA的细胞很少,必须通过对药物的抗性筛选进行扩增或通过表型变化进行鉴定。
稳定基因表达实验需要数周,如果需要验证蛋白产量,所需的时间更长,但得到的细胞系可以做为蛋白生产的稳定来源或用于得到转基因动物。
08
瞬时转染和转染效率的监测
基因的瞬时表达在24-72小时内就结束了。这种快速的瞬时表达非常适用于验证质粒表达和监测转染步骤的效率。
可以使用报告基因来确定优化条件,其表达蛋白易检测,在目的细胞中不含此蛋白或水平很低。常用的报告基因包括氯霉素乙酰转移酶(CAT),绿色荧光蛋白(GFP),荧光素酶(Lux或Luc)以及b- 半乳糖苷酶(b-gal)。可以使用简单的非同位素方法检测b-gal的表达以测定转染效率和活性。pCMV SPORT- bgal质粒包含CMV启动子调控下的LacZ基因,转染入真核细胞内后可以直接表达bgal。结合简单的检测步骤,可以做为监测转染条件的一种方便灵敏的方法。
09
稳定转染细胞系的筛选
连同带有药物抗性的筛选标记基因一起转染目的基因是建立稳定转染细胞系最常用的方法。氨基糖苷磷酸转移酶基因(APH或neor)可以合成APH酶,通过磷酸化使药物失活,从而提供对GENETCIN选择性抗生素(G418 Sulfate)的抗性。抗生素抗性基因可以与目的基因在同一个质粒上,也可以在不同的质粒上。如果两个不同的质粒同时转染,两个质粒都可能整合形成稳定转化子。对于两种不同质粒的共转染,带有目的基因的质粒和带有筛选标记的质粒间的比例为3:1或更高以保证抗性克隆带有转染的目的基因。
阳离子脂质体试剂提供了一种建立稳定转染株的高效方法。瞬时转染效率的改进一般也会提高稳定转染效率。比如,使用LIPOFECTAMINE PLUS试剂得到的NIH 3T3细胞GENETICIN抗生素抗性克隆的数目比单独使用LIPOFECTAMINE增加了大约3倍。要进行稳定的表达分析,在转染后次培养细胞,低密度铺板,给予生长空间,在几天或数周内保持筛选压力。
生长的细胞比不分裂的细胞更快的受到GENETICIN抗生素的影响。转染后,在开始筛选前等待48-72小时,使细胞表达足够量的抗性酶,保证在开始筛选时可以自我保护。转染后48-72小时倒掉培养基,加入含有GENETICIN抗生素的培养基,抗生素的浓度根据剂量反应曲线确定,足够杀死未转染细胞。因为许多因子影响到筛选所需的GENETICIN抗生素的最佳浓度,包括细胞类型,培养基和血清浓度等,所以有必要对每种细胞作一个剂量反应曲线,确定最佳浓度。
筛选最多可能需要一周时间,因为在致死剂量的GENETICIN抗生素存在条件下,细胞会分裂1-2次。在次培养细胞时使用较低剂量的抗生素,一般是筛选剂量的一半。筛选后的细胞一般是离散的克隆,根据实验目的不同,可以分别纯化(克隆),收集进行大量培养或染色并进行抗性克隆的计数。
10
蛋白表达和培养基的选择
哺乳动物细胞系合成可溶的,翻译后修饰的蛋白,比细菌,真菌或昆虫细胞中表达的蛋白更有可能有生物活性。
稳定转染的细胞可以合成大量的重组蛋白,而瞬时转染细胞可以快速表达,迅速地合成小量蛋白。常用的细胞系包括CHO,293和COS-7。Invitrogen提供克隆的293-F,293-H,COS-7和CHO-S细胞,来源于经筛选转染效率更高的亚细胞系。这些细胞也可用于无血清和限定化学成分培养基。重组蛋白的大规模生产一般在稳定转染的悬浮细胞中进行。这些细胞易于生长到高密度并合成更多蛋白,使用基质珠做为固相支持可以使贴壁细胞悬浮生长。
用于蛋白生产的细胞的转染可以在添加有血清或无血清培养基中进行。但更倾向于使用无血清培养基表达蛋白,因为血清蛋白会干扰下游表达蛋白的纯化。无血清培养基一般针对某一特定细胞类型优化并有几类无血清培养基不需要添加血清,一般含有不均一的或大量的蛋白(但比添加血清的培养基低得多)。
无蛋白培养基不含蛋白但可能含有不明成分的抽提物,限定化学成分的培养基不含有蛋白或未知组成的成分。多种多样的配方使您可以选择最适合您应用的一种。
在含血清时转染的细胞可以适应无血清培养基,无蛋白培养基或限定化学成分的培养基。在部分情况下(如293-F,293-H,COS-7和CHO-S),对于已适应无血清或无蛋白培养基的细胞,可以使用其培养基进行转染。其他一些无血清培养基包含抑制阴离子脂质体介导转染的成分,在这些情况下,有必要在诸如D-MEM或OPTI-MEMⅠ等培养基中进行培养和转染。
11
转染效率的验证
1、最有效的验证方式必须是qPCR验证;
2、荧光观察,使用病毒转染,明白自己病毒的情况,是荧光标记(一般是GFP)还是非荧光标记。质粒转染,可以在载体上添加荧光标记,帮助自己通过荧光观察转染效率。但是荧光并不能完全证明转染效率,还是通过核酸验证最为准确。
END
文章来源:CellMax胎牛血清
 文章推荐
文章推荐