
在我们实验中,养细胞是所有实验的基础,肿瘤细胞培养过程中,总会遇到这样那样的麻烦,以下几种情况,你是否遇到,如何解决,大师兄给你指明一二三。
如何判断细胞污染了?
状态 1: 细胞培养液变浑浊了,经常见到是米汤样,黄色液体,一般认为细菌污染。
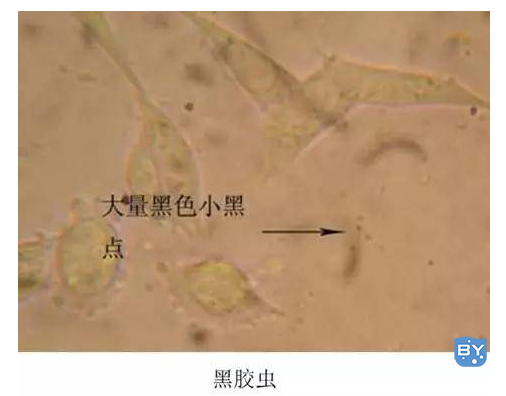
状态 2:细胞培养基内含有能动的小黑点,一般认为是黑胶虫。
状态 3:胞培养基清亮,但是能看到飘在培养液带有毛毛的白色的菌状物质,有可能就是真菌感染。
策略:细胞污染了就直接扔了,还得把培养箱用酒精棉球擦干净,并用紫外照射半小时,防止再次污染。同时建议细胞培养时,在培养基中加入青链霉素 (尤其是初学者)
细胞培养过程中,细胞周围包括细胞上有很多小黑点,怎么办?
策略 1:用胰酶消化下来后,低速短时间离心,不同实验室不一样,如果平时是 1 000 转 5 min 的话,就可以改为 700 转 3 min,用新的培养瓶培养细胞,细胞收集是少一点,但是一般都能干净很多。多传几代就好多了。
策略 2:如果多次尝试之后还是不干净,就怀疑是否存在支原体污染了,用抗支原体药就 OK 了。一般用上 3~5 天,细胞就干干净净了。
细胞培养过程中,发现贴壁细胞表面沾了很多死细胞,传代过程中一直存在怎么破?
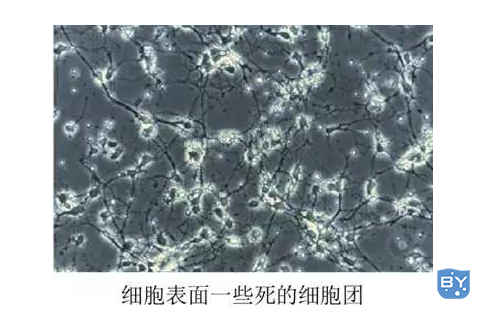
有一招屡试不爽,那就是用 PBS 洗两遍之后,加胰酶进去,晃一晃,迅速将胰酶倒出,再用 PBS 洗一下,再加胰酶正常消化。死细胞由于粘附能力很弱,第一次加胰酶进去以后会掉下来,第二次加胰酶下来的细胞才是活性比较强的细胞。整完一次之后,再次传代方法同上,一般 2~3 次之后,细胞就完好如初了。
细胞胞质疏松,状态不好,养不起来,怎么办?
策略 1:一般情况下,从血清下手就行,要么换好血清,要么提高血清浓度,血清浓度提高到 15%~20% 培养 48 h,换成正常 10% 的浓度,用高浓度的血清培养时间过长对细胞有毒性。
策略 2:血清下手之后可以同时采取提高细胞密度的方法,从培养瓶换到六孔板,12 孔板等,细胞密度大,细胞分泌的细胞因子多,肿瘤细胞通过旁分泌途径促进细胞生长。
预防策略:细胞胞质疏松,老化的原因在于细胞传代次数比较多,胰酶消化时间太长,这时候,一定要控制细胞传代次数,注意胰酶消化时间,胰酶消化时间过长,容易导致细胞状态不佳以及胞质疏松。有一招,元元没试过,可以尝试,将细胞冻起来,过段时间复苏,细胞会长得比较好。
 文章推荐
文章推荐