
实验方法原理
琼脂糖凝胶电泳是用琼脂糖作支持介质的一种电泳方法。其分析原理与其他支持物电泳的主要区别是:它兼有“分子筛”和“电泳”的双重作用。
琼脂糖凝胶具有网络结构,物质分子通过时会受到阻力,大分子物质在涌动时受到的阻力大,因此在凝胶电泳中,带电颗粒的分离不仅取决于净电荷的性质和数量,而且还取决于分子大小,这就大大提高了分辨能力。但由于其孔径相当大,对大多数蛋白质来说其分子筛效应微不足道,现广泛应用于核酸的研究中。
蛋白质和核酸会根据pH不同带有不同电荷,在电场中受力大小不同,因此跑的速度不同,根据这个原理可将其分开。电泳缓冲液的pH在6~9之间,离子强度0.02~0.05适合。常用1%的琼脂糖作为电泳支持物。琼脂糖凝胶约可区分相差100 bp的DNA/片段,其分辨率虽比聚丙烯酰胺凝胶低,但它制备容易,分离范围广。普通琼脂糖凝胶分离DNA的范围为0.2-20 kb,利用脉冲电泳,可分离高达107 bp的DNA/片段。
DNA分子在琼脂糖凝胶中泳动时有电荷效应和分子筛效应。DNA分子在高于等电点的pH溶液中带负电荷,在电场中向正极移动。由于糖-磷酸骨架在结构上的重复性质,相同数量的双链DNA几乎具有等量的净电荷,因此它们能以同样的速率向正极方向移动。
实验材料 DNA
试剂、试剂盒 琼脂糖TBE电泳缓冲液电泳载样缓冲液溴化乙锭(EB)溶液母液DNAGreen
仪器、耗材 水平式电泳装置电泳仪台式高速离心机恒温水浴锅微量移液枪微波炉或电炉紫外透射仪照相支架照相机及其附件
实验步骤
一、试剂配制
1. 5×TBE缓冲液:450 mmol/L Tris-硼酸,10 mmol/L EDTA,pH值8.0。使用时将上述储存液稀释10倍至0.5×TBE缓冲液,可同时作为电泳及制胶用的缓冲液。
二、制胶
1. 根椐制胶量及凝胶浓度,在加有一定量的电泳缓冲液的三角锥瓶中,加入准确称量的琼脂糖粉(总液体量不宜超过锥瓶的50%
容量)。琼脂糖粉末与0.5×TBE buffer的比例(w:v)参考表1,常用琼脂糖浓度为0.7-1%。
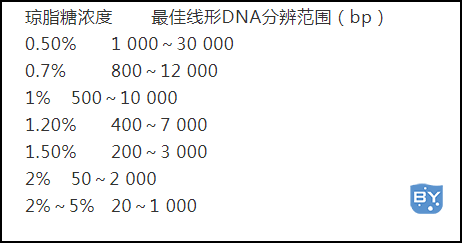
琼脂糖凝胶浓度与线形DNA的分辨范围
2. 在锥瓶的瓶口上盖上保鲜膜或牛皮纸,并在膜或纸上扎些小孔,然后在微波炉中加热溶解琼脂糖。加热时,当溶液沸腾后,请戴上防热手套,小心摇动锥瓶,使琼脂糖充分均匀溶解。此操作重复数次,直至琼脂糖完全溶解。
3. 使溶液冷却至50℃-60℃左右,如需要可在此时加入溴化乙锭溶液(终浓度0.5 μg/ml)或按照1 μL / 30 mL的比例加入DNAgreen染料,并充分混匀。
4. 将琼脂糖溶液倒入制胶模中,然后在适当位置处插上梳子。凝胶厚度一般在3~5 mm之间。制胶模如下图所示,小胶倒入25-30 mL左右琼脂糖溶液,大胶则60-70 mL左右,若需切胶回收,凝胶可适当加厚。
5. 在室温下使胶凝固,大约30分钟~1小时。
三、上样
1. 取适量样品与6×上样缓冲液混匀(如:1 μl样品与5 μl 6×上样缓冲液),用微量移液枪小心加入样品槽中。
2. 上样量根据样品浓度可适当调整,若DNA含量偏低,则可依上述比例增加上样量,但总体积不可超过样品槽容量(一般小孔40 μl 为上限,大孔200 μl 为上限,具体和制胶膜规格相关)。
3. 每加完一个样品要更换枪头,以防止互相污染,注意上样时要小心操作,避免损坏凝胶或将样品槽底部凝胶刺穿。
四、电泳
1. 加完样后,合上电泳槽盖,立即接通电源。控制电压保持在110 V,电流在40 mA以上。
2. 当条带移动到距凝胶前沿约2 cm时(约40 min),停止电泳。
3. 紫外下拍照并观察。
注意事项
1. 5×TBE缓冲液放置时间过久会沉淀,因此一次性不要配太多。工作用电泳缓冲液为0.5×TBE缓冲液,取5×TBE缓冲液贮存液稀释,现配现用。
2. 用于电泳的缓冲液和用于制胶的缓冲液必须统一。
3. 琼脂糖粉在微波炉中加热时间不宜过长,每次当溶液起泡沸腾时停止加热,否则会引起溶液过热暴沸,造成琼脂糖凝胶浓度不准,也会损坏微波炉。溶解琼脂糖时,必须保证琼脂糖充分完全溶解,否则,会造成电泳图像模糊不清。
4. 凝胶不立即使用时,请用保鲜膜将凝胶包好后在4℃下保存,一般可保存2~5天。
 文章推荐
文章推荐