
分子生物学研究对提取RNA要求较高,纯度高、完整性好、含量高的RNA是获得实验成功的关键和前提。小编给各位小伙伴总结了以下RNA提取常见问题及RNA质量的评估方法:
常见的RNA提取方法有异硫氰酸胍-苯酚法(Trizol法)、离心柱法和磁珠法。Trizol法是动物组织及动物细胞总RNA提取最常用的方法。Trizol法裂解能力较强,尤其适合小样本及特别难提取的组织,如皮肤,动物结缔组织等总RNA的提取;另外Trizol作为一种通用型的裂解试剂,还可以用于植物组织、细菌、真菌等组织的提取。离心柱法是一种十分稳定的RNA提取方法,电泳条带较为均一,但分子量较小的RNA会被过滤掉。磁珠法是使RNA与纳米磁珠结合,在磁场作用下,磁珠-核酸复合物与液体分离,再把核酸从磁珠上洗脱下来。对于含多糖多酚的植物组织如油茶、茶叶、油菜等还可以使用CTAB法进行总RNA的提取。那么在RNA提取过程中如何防止RNA降解,保证RNA质量?
如何避免RNA降解?
1.避免RNA酶的产生:
A 、避免内源性RNAase:
内源性RNAase是造成RNA降解的最重要原因。收集样本时,内源性RNA酶释放,降解RNA,降解速度与酶含量和温度有关,所以收集样本时必须马上进行内源RNA酶的失活。内源性RNAase失活方法:①迅速研磨破碎后加入裂解液中保存;②立即切成小块投入液氮中保存;③使用RNAlater保护剂等。
B、避免外源性RNAase:
使用无RNase的塑料制品和枪头,玻璃器皿要消毒避免交叉污染,注意:戴帽子、戴口罩、橡胶无菌手套,在清洁灰尘少的试验台提取。
2.提高RNA提取效率:
A 、组织RNA提取:
选用新鲜组织,这样RNA提取的效果比较好;如果不是新鲜的(最好在半年之内,-80℃或者液氮中冻存的)组织,注意不要反复冻融,从冰冻状态拿到0-4℃,待组织解冻后,用DEPC泡过的剪刀剪一小块组织,称重后,放到预冷的匀浆器中,进行匀浆处理。注意:速度不要太快,要有间隙,否则由于摩擦产热,RNA遇热会加速降解。如果一次做多个标本的RNA提取,也要这样做,更不能急。后面的步骤和细胞RNA提取一样。
B、培养细胞的RNA提取:
贴壁细胞,需要先用胰酶消化后,然后收集到离心管中,离心,去上清然后用PBS多洗2-3次,以去除多余的胰酶。悬浮细胞,直接用吸管或者加样枪吹打,以使细胞基本可以被吹下来。然后离心去上清,不需要用PBS洗。
如何确认RNA质量的好坏?
1. RNA溶液纯度的检测:
RNA溶液在280、320、230、260nm下的吸光度分别代表了核酸、背景(溶液浑浊度)、盐浓度和蛋白等有机物的值。一般我们通过OD260/OD280的值来判断RNA纯度:
OD260/280的值在1.9-2.1之间,认为RNA纯度较好;
OD260/280的值小于1.8时,表明蛋白质杂质较多;
OD260/280的值大于2.2时,表明RNA已经降解;
注意:如果用TE溶液洗脱RNA,会使OD260/280的值偏大。
2. RNA完整性的检测:
1)通过琼脂糖凝胶电泳检测28s和18s条带,28s条带宽度为18s条带的两倍;
2)通过色谱方法检测,RIN值:28s/18s为1.8-2.0,表明RNA完整性较好,基本无降解发生。
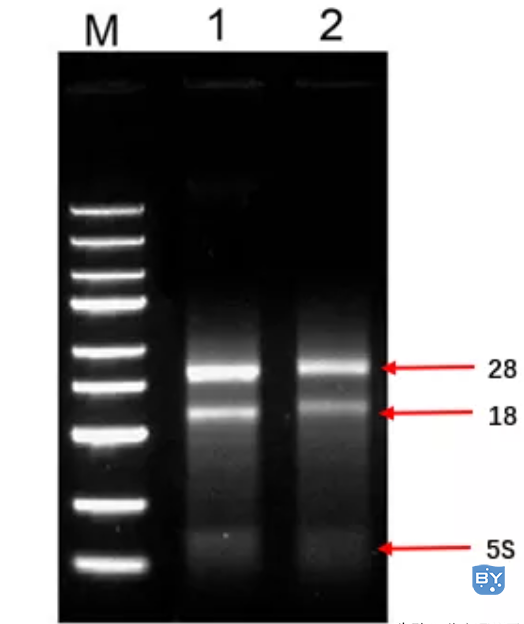
RNA电泳带型的特征:
☑RNA应该呈现出3条rRNA带。分别是5、18、28SrRNA条带。
☑28s亮度是18s亮度的一倍,其他比例关系均提示RNA有一定程度的破坏。
☑不能有多的带出现,出现多的带有两个可能:一是DNA污染带;二是rRNA破坏断裂带。
☑rRNA之间可以看到很淡的、雾蒙蒙的mRNA拖带。
☑ 琼脂糖凝胶被RNAase处理后电泳带基本消失,没有明显的、边缘清晰的带残留(如果有残留就是明显的DNA污染,而且是很大量的 DNA污染。
参考文献:
[1]Vermeulen J, De Preter K, Lefever S. Measurable impact of RNA quality on gene expression results from quantitative PCR[J]. Nucleic Acids Res 39 2011 :e63.
 文章推荐
文章推荐