
体外:
细胞划痕实验
Transwell
体内:
裸鼠尾静脉注射
1
细胞划痕实验
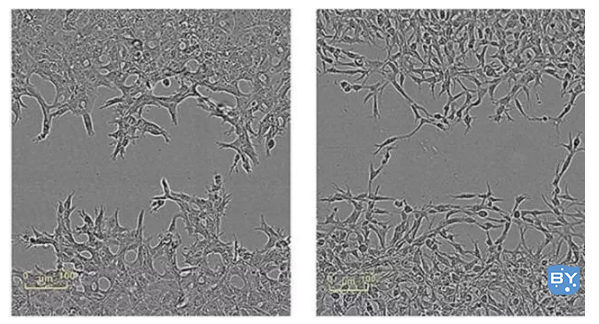
细胞划痕实验是一种简单易行的检测细胞运动的方法,实验成本低,可以检测贴壁生长肿瘤细胞的迁移能力。
实验优点:
1)在一定程度上模拟了体内细胞迁移的过程。
2)适合研究细胞与胞外基质(ECM)、细胞与细胞之间相互作用引起的细胞迁移。
3)与包括活细胞成像在内的显微镜系统兼容,可用于分析细胞间的相互作用。
4)研究细胞迁移的体外实验中最简单的方法。
实验材料:
1)细胞样品
2)仪器、耗材:6孔板 Marker笔 直尺 枪头
3)试剂、试剂盒:无血清培养基、PBS
实验步骤:
1)所有能灭菌的器械都要灭菌;
2)超净工作台紫外线消毒30min;
3)6孔板背面画线5-6条;
4)每孔加入5x10 5个细胞并培养约24h;
5)用1ml枪头垂直于孔板和线制造细胞划痕,尽量保证各个划痕宽度一致;
6)吸掉旧培养基,用无菌PBS冲洗细胞3次,去除划下的细胞后,再加入无血清培养基,根据需要设加实验组、对照组;
7)放入37℃ 5%二氧化碳培养箱,培养。按0、6、12、24小时取样拍照。
2
Transwell
Transwell:
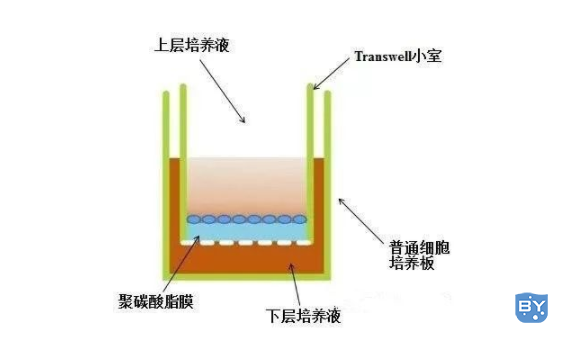
Transwell是一种应用Transwell小室来探究细胞共培养、细胞趋化、细胞迁移、细胞侵袭等问题的实验技术。
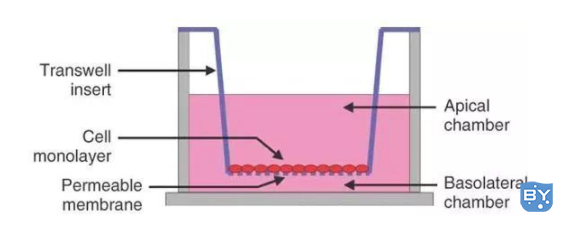
材料准备及说明:
1)Transwell小室:常用8.0μm膜,铺胶130rmb、不铺胶40rmb,可重复利用;
2)上层培养液:无血清培养基,为维持渗透压,需要加入0.05%~0.2% BSA;
3)细胞:有侵袭能力的细胞
先撤血清让细胞饥饿12~24h,再进行实验;
4)基质胶:常用的是人工重构基底膜材料Matrigel;
5)下层培养液:含5%~10% FBS的培养基。也可用趋化因子;
6)细胞培养板:6孔板、12孔板、24孔板等,以24孔最常用。
实验步骤:
1.Transwell小室制备:
1)包被基底膜:用50mg/LMatrigel 1:8稀释液包被Transwell小室底部膜的上室面,4℃风干;
2)水化基底膜:吸出培养板中残余液体,每孔加入50ul含10g/LBSA的无血清培养液,37℃,30min。
2.取细胞悬液加入Transwell小室,24孔板小室一般200μl。细胞密度为1~10x10 5个。
3.24孔板下室一般加入500μl含FBS或趋化因子的培养基。
4.培养细胞:常规培养48h
5.结果测定:
1)直接测定:细胞染色,镜下计数;
2)间接测定:MTT法、荧光试剂检测、结晶紫染色。
3
裸鼠尾静脉注射
小鼠转移模型分类:
1.人工转移模型:将肿瘤细胞体外培养或腹水进行注射,在肺(尾静脉注射)、脑(颈动脉注射)、肝脏(肝动脉注射)等部位观察。
2.自发转移模型:肿瘤细胞接种在小鼠腋部或足趾的皮下、腹腔肌肉或原组织中,观察转移灶。
实验步骤:
1.裸鼠选择:4~6周裸鼠;
2.细胞的选择:查阅文献选择合适细胞株;
细胞浓度:动物肿瘤一般接种2~600万/只就100%成瘤,而人癌则需要1000万以上才能较高的成瘤;
3.注射技巧:
1)固定:50ml离心管自制或购买成品;
2)注射位置:鼠尾部侧面的两条静脉,一般在尾部远端的1/3到1/2处进针。
3)注射:选择1~2ml注射器,针头采用4号或4.5号;
4)凸显静脉:温水、烤灯等。
4.观察结果:
1)影像
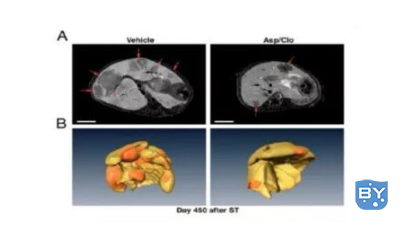
2)大体解剖测量:
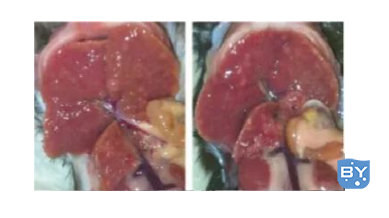
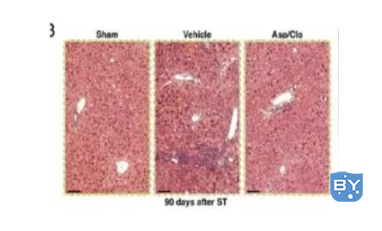
3)组织切片染色
 文章推荐
文章推荐