
在分子生物学研究中,有很多实验需要获得目的基因的序列进而确定基因的表达水平,这就需要得到样品中高质量、高纯度的RNA,本文就RNA提取的原理、方法和注意事项进行总结。
RNA提取的基本原理
裂解过程
高浓度蛋白质变性剂的裂解方法,是抽提RNA的首选方案。
总RNA的抽提,最重要的是快速裂解细胞膜,而在DNA提取过程中存在的基因组与蛋白质“缠”住的问题,并不会对后续的纯化过程产生大的影响,可以不考虑。
高浓度蛋白质变性剂能快速破坏细胞膜,进而迅速抑制住细胞内的RNA酶,从而保证了RNA的完整性,绝大部分样品的RNA抽提方法,都是以高浓度的蛋白质变性剂为基础的。
RNA提取
最近原准备去做RNA-seq,但是遗憾的是败在了RNA上,不是浓度不够,而是发现不够完整,这个时候肯定会说重新提过,多么简单,但是样品本身RNA已经降解,重新提过也枉然,肯定又会说重新取样,但是有时候就是连重来的机会都没有。
有一些客观原因没有办法避免,但是舍不得样品浪费,所以只好做了蛋白组,并不是说蛋白组不好,只是当现实照不进梦想,总是会有遗憾。所以这一次强行插入RNA提取。
RNA提取是我们一般都必备的实验技能,有很多试剂盒来提取,但是原理都大同小异,所以我们这期只探讨Trizol,试剂盒实在太多,就不一一举例了。
Trizol试剂是一个包含酚、异硫氰酸胍和SDS的单相酸性溶液,能迅速破碎细胞,其在裂解细胞的同时抑制RNase的活性,抑制细胞释放出的核酸酶。随后加入氯仿,会大量地溶解在氯仿中。由于DNA和RNA在酸性酚中的溶解性不同,造成DNA分布在下层的氯仿酚溶液中,RNA则分布在上层的水相中,最后用异丙醇沉淀水相中的RNA,并用70%乙醇洗涤沉淀,这样就可以得到比较纯净的总RNA,用这个方法提出来的RNA纯度浓度都不会太差,而且也简单易学,如果说缺点在哪里,那么某些试剂的毒性和刺激性一定要注意安全,下来我们详细探讨一下步骤。
实验步骤:
RNase污染的主要来源是操作过程中手和空气中的浮沉,注重配带手套口罩帽子,不要交流,打喷嚏,样品尽可能盖严。
1.A. 细胞。取出六孔板,弃去培养基,用预冷的PBS洗2遍,一定要把PBS吸干净。加入1ml Trizol裂解细胞,用细胞刮刮下细胞,转移到一个新的无酶1.5ml EP管中,室温静置5min(使核酸蛋白复合物完全分离)。
B. 组织。50-100mg组织/ml Trizol加入Trizol,如果你不想去称量,用匀浆器匀浆(匀浆器需要在用之前用DEPC水泡过,消毒)。转移到一个新的无酶1.5ml EP管中,室温静置5min。
2.加氯仿1/5 Trizol体积 ,把EP管盖子盖紧,用手上下左右晃动10次左右(摇晃时应注意离心管盖以防未盖紧使溶液漏出),使其混匀(在室温下静置5-10 min(避免涡旋震荡,以免DNA链断裂)。然后,运用低温离心机4℃,1,0000 rpm/min,离心15min。分为3层,水相层包含RNA在上层,有机层在下层,中间层是DNA和蛋白质。
3.小心吸取上清液,切忌吸出白色中间层,转移至另一新的无酶EP管中。加入等体积的异丙醇(大约为500μl),用手上下摇晃,室温静置10min。低温离心机4℃,离心15min,12,000 rpm/min。
4.倒掉上清液,加1ml 75%无水乙醇 ,用手轻轻震动洗涤管壁,低温离心机4℃,离心5min,12,000 rpm/min,为了避免减少盐物质及碳源物质干扰,此处建议用75%无水乙醇清洗两次。
5.上清倒掉,放置室温(EP管倒置在滤纸上),使RNA干燥沉淀(注意不要加热干燥或离心,要不然RNA将很难溶解)。加DEPC水30μl于EP管中。
6.测RNA浓度:将仪器打开,先用DEPC水调零(滴加DEPC水3次调零后,并测量是否准确,这个时候千万不要为了方便只调零一次,否则在你测浓度的时候不准会发现更费时间)。吸取1-2μl待测RNA(每次我用的1.5ul,因为1ul有时候有点少,又要反复测,反而更浪费,2ul我又觉得有点多,舍不得),慢慢滴于仪器上,把RNA浓度值记录下来,以便在逆转录时使用。同时至少要记录260/280值(1.8-2.1),纯RNA的OD260/OD280的比值为2.0。
7.逆转录:我一直用的takara的,感觉比较好,将RNA溶液快速离心,同时将无酶EP管放于冰上,配置10μl的体系,加gDNA Eraser 1μl,5×gDNA Eraser Buffer 2.0μl,RNA溶液质量根据浓度计算最好超过1μg(这个时候就知道RNA浓度的重要性了,RNA浓度最好在500-1000,这样你加的时候就会在1-2ul,不至于太少也不至于太多,如果浓度低,这个时候大家一定想起了高师姐的浓缩),最后加RNase free ddH2O至10μl,用涡旋震荡混匀。将反应液置于室温5min。加入上述变性、退火反应后的EP管中,为20μl体系:
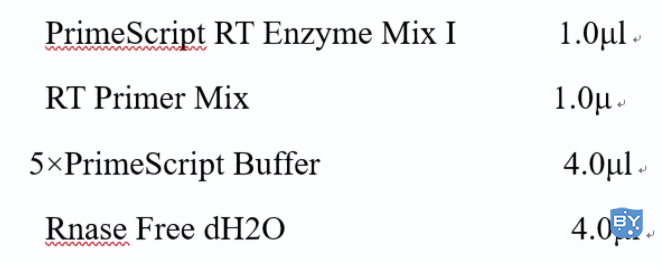
轻轻混合均匀,在PCR仪上按37℃,15min,85℃,5s , hold,4 ℃,条件进行逆转录音。逆转录之后的RNA已经相对比较稳定,可以放在-80℃,我觉得用RNA来做PCR的应该会相对多一些,肯定会问只有20ul,是不是会少,不会的,在做QPCR的时候我调整了比例,都用不到1ul,而且可以做出来,所以做20多次的量如果不够,那么可能需要多加练习。
注意事项
样品的采集和保存
以RNA提取为目的的样品,在采样时就要根据RNA提取的实验设计进行分装,在RNAlater中保存 (推荐QIAGEN生产的),4℃运输并过夜,以保证RNAlater充分与样品细胞结合,从而完成RNA的固定,之后转入-20℃保存,如需长期保存 (几个月以上),应当在-80℃下保存。
提取过程中的注意事项
所有实验所用的枪头、离心管等消耗品均要使用RNase-free的;
整个过程要在无RNase污染的条件下进行,通常可以在无菌操作台中进行实验,并用75%的酒精进行擦拭杀菌,如有必要也可在实验前喷洒一些商用的RNase抑制剂;
所有相关溶液的配制要使用RNase-free水或DEPC水 (包括75%酒精也需要用无水乙醇与DEPC水配制);
溶液的配制使用移液器进行操作,切勿使用量筒等中间器皿;
研钵、研棒、镊子、剪刀等用锡箔纸包好后,200℃干热灭菌4h;
实验过程中一定要戴手套和口罩;
异丙醇、氯仿、乙醇等试剂要使用未开封的,或者开封之后直接分装至小容量离心管的,以避免多次使用的交叉污染;
注1:现在一般实验室都使用从公司直接购买的RNase-free水,这种水通常都是大包装,比如100mL一瓶,在第一次使用的时候,开盖后一定要将其分装到1.5或2mL RNase-free离心管中,在冰箱中保存,每次实验用多少取多少,避免多次实验的交叉污染。
注2:一定要戴口罩!!!不要怕麻烦,因为你真没法保证实验过程中不打喷嚏!!!
 文章推荐
文章推荐