
免疫荧光染色及成像分析是研究组织形态和组织原位抗原表达不可或缺的检测技术,广泛应用于临床病理诊断和医学及生物学研究的各个领域。近年来,用于炎症消除、肿瘤消融的治疗方法层出不穷,而免疫荧光染色技术是用以评估其治疗效果的有效手段。因此,总结了免疫荧光染色在测定促炎性细胞因子、分析肿瘤微环境等方面的应用。
PART.01
表征巨噬细胞的表型变化
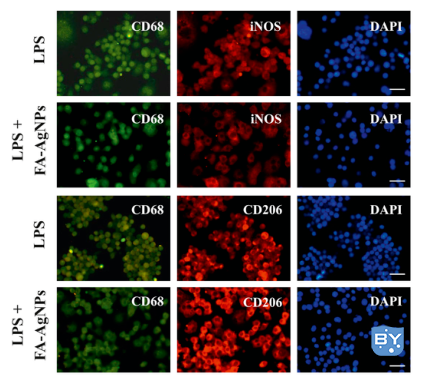
图1. 表征巨噬细胞的表型变化[1]
巨噬细胞可以存在两种不同的表型,即促炎(M1)和抗炎(M2)表型。因此,将巨噬细胞从M1表型转换为M2表型是治疗炎症的一种潜在方法。通常通过对M1(iNOS,红色)和M2(CD206,绿色)标记物进行免疫荧光染色来评估巨噬细胞的表型变化。图1可以看出在FA-AgNPs处理后,iNOS(M1标志物)信号减少,而CD206(M2标志物)信号变得明显,表明巨噬细胞从M1型有效地复极化到M2型。说明FA-AgNPs可通过调节巨噬细胞极化,进而调节炎症细胞因子的表达而发挥抗炎作用。
PART.02
表征热休克蛋白的表达
![图2. 表征热休克蛋白的表达[2] 图2. 表征热休克蛋白的表达[2]](/static/upload/image/20220621/1655775983167526.png)
图2. 表征热休克蛋白的表达[2]
在高于体温5℃的条件下,癌细胞会异常过表达热休克蛋白(HSPs),以提高自身的耐热性和稳定性。因此,调节癌细胞内HSPs的表达可以实现温和的光热疗法(PTT)从而促进癌细胞的凋亡。其中HSP-90、HSP-70是主要的应激诱导蛋白质,通过对其进行免疫荧光染色来表征热休克蛋白的表达。图2所示无论是否有激光照射,HmPGTL NPs均可下HSP-90和HSP-70的表达,从而降低肿瘤的耐热性,增强温和PTT的疗效。
PART.03
测定炎性因子
![图3. 测定促炎性细胞因子[3] 图3. 测定促炎性细胞因子[3]](/static/upload/image/20220621/1655776009927204.png)
图3. 测定促炎性细胞因子[3]
白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)是参与多种生理与免疫过程的重要细胞因子,是参与全身炎症反应综合征、脓毒症的重要炎症介质,通过对其免疫荧光染色处理后可反映感染的严重程度。图3显示未经DNase-CO@MPDA纳米粒子处理的创面呈现出大量的红色和绿色荧光斑点,表明创面分别分泌了大量的IL-6和TNF-α,这表明存在严重的炎症反应。当感染创面接受DNase-CO@MPDA NP治疗时,炎症反应可通过减少炎症细胞因子的分泌而在一定程度上减轻。
PART.04
表征血管生成
![图4. 表征血管生成情况[4] 图4. 表征血管生成情况[4]](/static/upload/image/20220621/1655776044868836.png)
图4. 表征血管生成情况[4]
CD31又称血小板-内皮细胞黏附分子,主要用于证明内皮细胞组织的存在及评估血管生成。通常对CD31进行免疫荧光染色来观察感染组织治疗过程中的血管生成情况。图4显示UCNPs/PSeV在经激光照射后红色荧光信号明显增加,其微血管密度是其他组的4倍。
PART.05
表征肿瘤相关成纤维细胞(TAFs)的形成
![图5. 表征肿瘤相关成纤维细胞(TAFs)的形成情况[5] 图5. 表征肿瘤相关成纤维细胞(TAFs)的形成情况[5]](/static/upload/image/20220621/1655776067404438.png)
图5. 表征肿瘤相关成纤维细胞(TAFs)的形成情况[5]
肿瘤微环境在肿瘤转移中起重要作用,肿瘤相关成纤维细胞(TAFs)是肿瘤微环境的主要成员。肿瘤细胞分泌的 TGF-β 将正常成纤维细胞(NAF)激活为 TAF。然后TAFs成为促进肿瘤细胞转移的TGF-β的主要来源。因此,抑制TAFs的形成和调节肿瘤微环境可以有效降低TGF-β的分泌,阻碍肿瘤的转移。通常对TAFs的标志物α-SMA(绿色)进行免疫荧光染色来表征TAFs的形成情况。图5所示经过NLC/H(D+F+S)NPs处理后,绿色荧光最弱,说明TAFs的标志物α-SMA减少,从而抑制了TAFs的形成。
PART.06
评估ICD的发生
![图6. 评估ICD的发生[6] 图6. 评估ICD的发生[6]](/static/upload/image/20220621/1655776094140555.png)
图6. 评估ICD的发生[6]
免疫原性细胞死亡(ICD)可通过激活树突状细胞(DCs)和触发细胞毒性T细胞反应来启动肿瘤杀伤作用,从而引起显著的免疫反应。ICD诱导的垂死的癌细胞可以上调细胞表面的钙调蛋白(CRT)以产生“Eat me”的信号,促进DCs对其识别和吞噬,呈现肿瘤抗原,因此常选取CRT为指标,以考察ICD是否发生。如图6所示,经TA-OBL处理后,CRT表达明显上调,表明该治疗方法可激活ICD,促进免疫治疗。
PART.07
检测Foxp3和CD8+ T细胞的表达
![图7. 检测乳腺癌组织中Foxp3和CD8+T细胞的表达情况[7] 图7. 检测乳腺癌组织中Foxp3和CD8+T细胞的表达情况[7]](/static/upload/image/20220621/1655776119147282.png)
图7. 检测乳腺癌组织中Foxp3和CD8+T细胞的表达情况[7]
CD8+ T细胞介导Ⅰ型免疫反应,可增强CD8+和CD4+ T细胞的积聚,并促进其抗肿瘤作用。叉头状转录因子p3(Foxp3)是CD4+CD25+ Tregs的特异性生物标志,其在肿瘤免疫中也发挥重要作用。既往的研究表明,Foxp3的高表达意味着较差的预后而CD8+肿瘤淋巴细胞浸润意味着预后较好。往往采用免疫荧光染色评估乳腺癌组织中Foxp3阳性Tregs及CD8+T细胞的表达情况,来评价某一手段治疗乳腺癌的效果。如图6所示,采用CD8+(红色)和Foxp3+(绿色)抗体对肿瘤切片进行染色,经第7组处理后CD8+ T细胞在Tregs中所占比例相对较高,说明该处理方式能有效抑制肿瘤生长。
PART.08
表征肿瘤低氧状态
![图8. 表征肿瘤低氧状态[8] 图8. 表征肿瘤低氧状态[8]](/static/upload/image/20220621/1655776143196970.png)
图8. 表征肿瘤低氧状态[8]
实验中常通过测定低氧诱导因子-1α(HIF-1α)的表达状况以评估肿瘤处的低氧状态。如图8所示,C. butyricum组中呈微弱的绿色荧光,表明HIF-1α的表达显著降低,证明其可以改善黑色素瘤的乏氧环境,这有助于提高光敏剂D-Ala-TPApy的光动力治疗的效果。
PART.09
细胞凋亡
![图9. 细胞凋亡[9,10] 图9. 细胞凋亡[9,10]](/static/upload/image/20220621/1655776166481752.png)
图9. 细胞凋亡[9,10]
除了常用的Tunel染色外,也常通过考察Caspase-3的表达来评估细胞的凋亡程度。Caspase-3免疫荧光图像显示,空白组及各个对照组中并未展现出明显的红色荧光,表明小鼠的肿瘤区域未见明显的凋亡,而ANBDP NPs处理组小鼠经NIR激光照射后,Caspase-3表达明显上调,表明ANBDP NPs的治疗效果更加优异。
PART.10
参考文献
1. Yang Y, Guo L, Wang Z, et al. Targeted silver nanoparticles for rheumatoid arthritis therapy via macrophage apoptosis and Re-polarization. Biomaterials, 2021, 264: 120390.
2. Wang P, Kankala R K, Chen B, et al. Cancer cytomembrane-cloaked prussian blue nanoparticles enhance the efficacy of mild-temperature photothermal therapy by disrupting mitochondrial functions of cancer cells. ACS Appl. Mater. Interfaces, 2021, 13, 37563-37577.
3. Yuan Z, Lin C, Dai L, et al. Near‐Infrared Light‐Activatable Dual‐Action Nanoparticle Combats the Established Biofilms of Methicillin‐Resistant Staphylococcus aureus and Its Accompanying Inflammation. Small, 2021, 17, 2007522.
4. Zhou K, Qiu X, Xu L, et al. Poly (selenoviologen)-assembled upconversion nanoparticles for low-power single-NIR light-triggered synergistic photodynamic and photothermal antibacterial therapy. ACS Appl. Mater. Interfaces, 2020, 12(23): 26432-26443.
5. Zhang J, Yang J, Zuo T, et al. Heparanase-driven sequential released nanoparticles for ferroptosis and tumor microenvironment modulations synergism in breast cancer therapy. Biomaterials, 2021, 266, 120429.
6. Tumor-activated size-enlargeable bioinspired lipoproteins access cancer cells in tumor to elicit anti-tumor immune responses, Adv. Mater., 2020, 32, 2002380.
7. Jin F, Qi J, Liu D, et al. Cancer-cell-biomimetic Upconversion nanoparticles combining chemo-photodynamic therapy and CD73 blockade for metastatic triple-negative breast cancer. J. Control. Release, 2021, 337, 90-104.
8. Living bacteria-based immuno-photodynamic therapy: Metabolic labeling of Clostridium butyricum for eradicating malignant melanoma, Adv. Sci., 2022, 2105807.
9. Supramolecular self-assembly-facilitated aggregation of tumor-specific transmembrane receptors for signaling activation and converting immunologically cold to hot tumors, Adv. Mater., 2021, 33, 2008518.
10. Proton-driven transformable 1O2-nanotrap for dark and hypoxia tolerant photodynamic therapy, Adv. Sci., 2022, 2200128.
 文章推荐
文章推荐