
跑电泳是分子生物学实验的一项基本技术。只要做分子生物学方面的实验,可能或多或少,或早或晚都要跑跑电泳。
跑电泳的材料是琼脂糖,琼脂糖凝胶电泳实验常用以DNA 切胶回收,DNA 分离和用于佐证DNA 是否重组、质粒等是否切开。今天我们就来聊聊琼脂糖凝胶电泳实验的一些小技巧小细节。
1 凝胶制作
1.1 凝胶浓度 配制凝胶的浓度据实验需要而变 ,一般在0.8% ~2.0%之间,如果一次配制凝胶100 ml,没用完的凝胶可以再次融化,但随着融化次数的增加,水分丢失也越多,凝胶浓度则会越来越高,导致实验结果不稳定,补水办法:一是在容器上标记煮胶前的刻度,煮胶后补充相应的水分至原刻度;二是在煮胶前称重,煮胶后补充水至原重量。粗略一点的方法是通过多次较恒定的煮胶条件得出一个经验补水值。以保证凝胶浓度基本维持在原浓度。核酸染色剂溴化乙锭(ethidium bromide)可加在融化的琼脂糖中,终浓度为0.5 t*g/ml;也可在电泳结束后染色。
1、2 梳板的选用 一般每个制胶模具均配有多个齿型不同的梳板,梳齿宽厚,形成的点样孑L容积较大,用于DNA 片段回收实验等;相反,梳齿窄而薄,形成的点样孑L容积就较小,用于PCR产物、酶切产物鉴定等。梳板的选择主要是看上样量的多少而定,一般来说,上样量小时尽量选择薄的梳板制胶,此时电泳条带致密清晰,便于结果分析。另外,每次制胶时都要注意梳齿与底板的距离至少要1 mm,否则,拔梳板时易损坏凝胶孑L底层,导致点样后样品渗漏。当然,点样孑L的破坏还与拔梳板的时间和方法有关,一般凝胶需冷却30 min以上方可拔梳板,应急的情况下可以将成型的凝胶块放4℃ 冰箱中冷却15 min 左右,拔梳板的方法是将制胶槽放置在电泳槽中的电泳缓冲液中,然后垂直向上慢慢用力,因为有液体的润滑作用,梳板易拔出且不易损坏点样孑L。
2 点样
点样需加上样缓冲液,因为上样缓冲液中加了甘油或蔗糖增加密度,使样品沉入孑L底;指示样品的迁移过程,上样缓冲液中一般加了两种指示剂,溴酚兰和二甲苯青(值得注意的是指示剂并非染色剂,DNA染色剂是溴化乙锭,而且要在紫外光的激发下才能看见桔红色荧光)。上样缓冲液储存液一般为6× (10×),表示其浓度为工作浓度的六倍。使用时上样缓冲液应稀释到一倍浓度。点样方法是将移液器基本垂直点样孑L,用另一只手帮助固定移液器下端,移液器枪头(Tip)尖端进入点样孑L即可将样品注入孑L内,千万不可将Tip尖插至孑L底,并点上适合的DNA分子量标准,所谓适合是指样品DNA分子量大小应基本在DNA分子量标准范围之内。
3 电泳
将电泳仪的正极与电泳槽的正极相连,负极与负极相连,核酸带负电荷,从负极向正极移动。电泳槽中电泳缓冲液与制胶用电泳缓冲液应相同,电泳缓冲液刚好没过凝胶1 mm 为好,电泳缓冲液太多则电流加大,凝胶发热。电泳时凝胶上所加电压一般不超过5 v/cm(指的是正负电极之间的距离,而不是凝胶的长度),电泳时间一般为3O~60 min,根据实验需要也可作适当调整,电压增高,电泳时间缩短,核酸条带相对来说不够整齐,不够清晰;相反,电压降低,电泳时间较长,核酸条带整齐清晰。另外,如果电泳后样品泳动很慢或者没泳动,请检查胶模两端的封口胶条是否已去掉。
4 结果分析
较成功的电泳结果是分子量标准条带整齐清晰,样品条带也整齐清晰,如果条带模糊暗淡,单从琼脂糖凝胶电泳角度来说,可能的原因:溴化乙锭的质和量怎样?溴化乙锭见光易分解,母液配制时间过长或保存不当(一般4℃ 避光保存一年内有效),或者终浓度没达到0.5 vg/ml;电泳槽中缓冲液使用次数过多,缓冲能力下降。特别是TAE缓冲液,一般用2~3次就要更换,TBE缓冲液则可使用10次左右。
实际工作中经常发现DNA 分子量标准小片段模糊不清,那足因为琼脂糖凝胶浓度一般不会超过2 0% ,较小的核酸片段在它的分辨范围之内,并且EB带正电荷,电泳时会向负傲移动,如果将凝胶置含EB(0.5#g/m1)的水溶液中30 min,较小的片段则可重新染色:另外,溴化乙锭(EB)是一种中等强度诱变剂,操作过程中要戴手套,并将加有EB的染色液作好标记、妥善保存。
除这些细节之外,还有一些注意事项:
1. 酶切时所加的DNA 溶液体积不能太大,否则DNA 溶液中其他成分会干扰酶反应。
2. 酶活力通常用酶单位(U)表示,酶单位的定义是:在最适反应条件下,1 小时完全降解1 mg λDNA 的酶量为一个单位,但是许多实验制备的DNA 不象λDNA 那样易于降解,需适当增加酶的使用量。反应液中加入过量的酶是不合适的,除考虑成本外,酶液中的微量杂质可能干扰随后的反应。
3. 市场销售的酶一般浓度很大,为了省着点儿花,使用时可事先用酶反应缓冲液进行稀释。另外,酶通常保存在50%的甘油中,实验中,应将反应液中甘油浓度控制在10%以下,否则,酶活性将受影响。
4. 观察DNA 离不开紫外透射仪,可是紫外光对DNA 分子有切割作用。从胶上回收DNA时,应尽量缩短光照时间并采用长波长紫外灯(300-360nm),以减少紫外光切割DNA。
5. EB 是强诱变剂,还有中等毒性,就是有致癌性。配制和使用时都要戴好手套。尽量不要把EB 洒到桌面或地面上。如果真的不幸洒到桌面或地面上了,凡是沾污了EB 的容器或物品必须经专门处理后才能清洗或丢弃。
6. 当EB 放太多了,胶染色过深,DNA 带看不清的时候,可将胶放入蒸馏水冲泡,30 分钟后再观察。
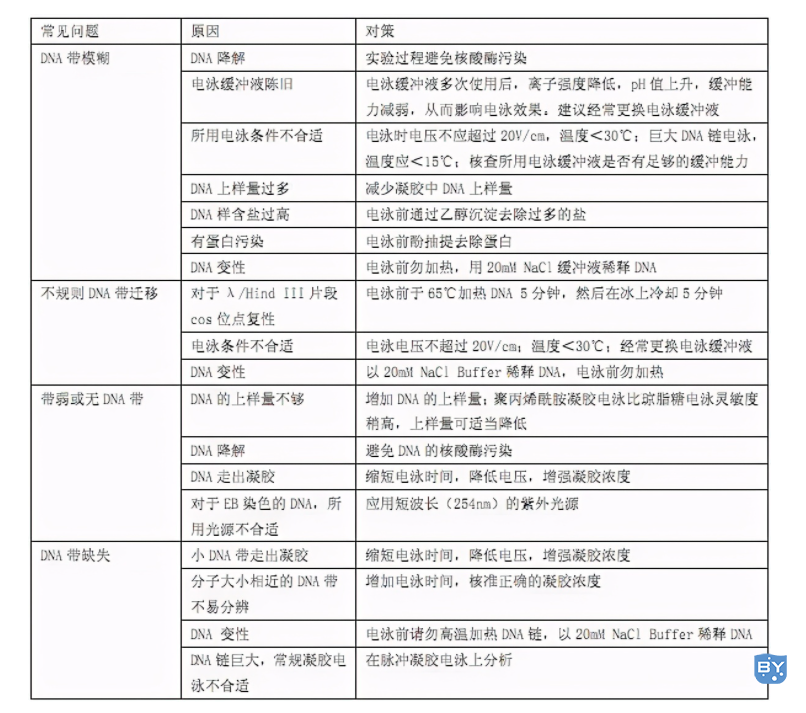
但有时候,跑电泳跑着跑着也会出现一些奇奇怪怪的现象。下面,就谈一谈跑电泳的过程中可能会发生的异常现象,可能的原因,以及对策。
 文章推荐
文章推荐