
在进行质粒制备时,获得良好的质粒产量至关重要。那么什么是好的收益呢?您如何优化您的制备以获得良好的质粒产量,是什么导致了低产量?我们将在下面介绍这些问题以及更多内容。
什么是质粒制备的好产量?
有三种主要的质粒制备类型:mini、midi 和 maxi。质粒 DNA 的量因方案和试剂盒而异,但表 1 提供了这三种不同制备方法的平均范围。

表 1.质粒制备的平均产量。
什么导致质粒产量低?
我们收到了来自 Bitesize Bio 读者 Sonia 的问题:“如果一个样品的产量很高,而另一个质粒的产量很差,当两个样品同时以相同的方式处理时,可能会出现什么问题。”
这是一个很好的问题,因为许多因素会导致质粒制备之间的产量差异。让我们一次一点地解开这个谜团,并讨论为什么在制备质粒时可能会获得低产量的一些原因以及您可以做些什么。
1. 有问题的插入
您使用完全相同的方案同时制备了两种质粒,但产量不同。如果质粒具有相同的骨架(即,它们都是 pUC 或 pBluescript 等),则原因倾向于插入起作用。
一些插入物可能对细菌有问题。可能是制造了一种使细菌生病的蛋白质(例如,DNase),或者可能是插入物不稳定(例如,重复序列)。
要克服这个问题,请尝试使用专门的感受态细胞系。对于不稳定的插入物,请尝试 Life Technologies 的STBL2细胞,而对于含有毒性蛋白质的克隆,请尝试 NEB 的T7 Express LysY/Iq Competent 细胞。
另一个重点是插入大小如何改变质粒的拷贝数。大的插入片段会减少质粒的拷贝数,这意味着您可能需要培养更多的细胞才能获得不错的产量。
2. 复制号码
如果将基因克隆到不同的载体中,那么问题可能是质粒以不同的速率复制。一种可能是高拷贝质粒,另一种可能是中等甚至低拷贝质粒。
低拷贝质粒的一些例子是那些使用主干 pBR322 和 pACYC 的质粒,它们较老,并且在今天的克隆工作中不经常使用。许多用于蛋白质表达的载体是中等拷贝。这是可取的,因为在生产蛋白质时,有时,如果生长太快,它会增加蛋白质变得不溶或形成包涵体的机会。
3. 文化过饱和
通过注意准备文化,您将始终获得最佳结果。从旧菌落接种或让培养物变得过于饱和会导致质粒复制和保留不良,从而严重影响质粒产量。
隔夜培养可能看起来很省时,但隔夜培养很容易变得过饱和并导致低产量。你希望你的文化处于滞后阶段而不是过度饱和。
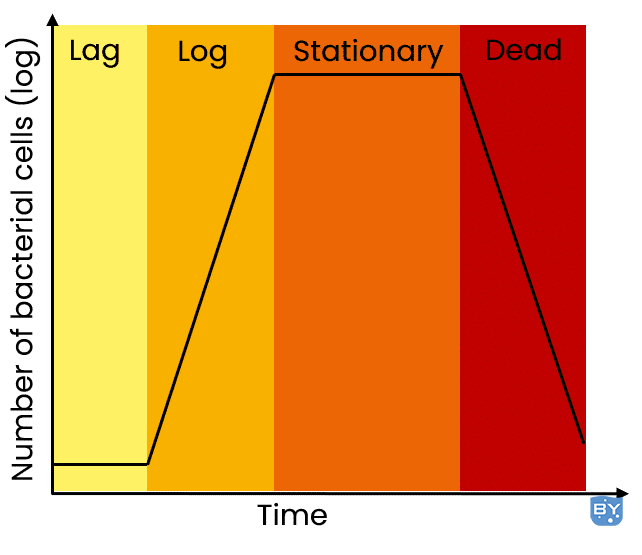
图 1.细菌生长曲线的各个阶段。
下面提供了过夜培养的替代解决方案。
培养不饱和培养物的简易协议
这适用于 midipreps,但可以针对其他准备类型进行调整。
从一个 新的 菌落开始,不超过几天。
早上用菌落接种 5 mL LB 起始培养物并生长直到 OD600 约为 1,然后在冰箱中储存过夜。
如果您使用氨苄青霉素作为选择载体,请将细胞沉淀并重悬于新鲜、不含抗生素的培养基中以去除分泌的 β-内酰胺酶。
第二天早上,用 1 mL 从起始培养物中接种 100 mL LB 培养物,用于高拷贝数质粒,将低拷贝质粒的体积加倍。
培养培养物直至 OD600 约为 3,然后将细胞沉淀并直接进行小量制备,或将细胞冷冻在 -20°C 并稍后继续。
如果您确实想要或需要在一夜之间培养您的培养物,请尝试使用 1:1000 稀释的起始培养物到大规模培养物中(因此 100 μl 到 100 ml 中)。
提醒一下,培养状态对于质粒的高产量至关重要。为获得最大产量,培养应处于对数后期或静止期早期。如果培养物过度生长,您将收获比活细胞更多的死细菌,这也会导致制备过程中的基因组 DNA 污染。如果培养物发育不全,那么产量当然低于预期。
4. 不成熟的文化
虽然过饱和是一个问题,但培养物的不足也是质粒产量的问题。您可能会错误地使用平板上的旧菌落或直接从冷冻原液而不是菌落开始培养。当您使用这两种方法中的任何一种时,细菌繁殖的滞后时间要长得多。
4. 使用旧殖民地
人们在设置他们的起始培养物或过夜培养物时忘记的另一点是你用来挑选菌落的盘子的年龄。如果你的盘子是旧的,你可能选择了一个不错的大菌落,但它不会都是活细胞。如果在抗生素不再存在的原始菌落周围有卫星菌落,这些菌落将没有质粒并被引入您的培养物中。因此,在开始之前先划一个新盘子,以确保获得最佳效果。
5. 抗生素问题
诊断低质粒产量时的一个重要考虑因素是抗生素。细菌在培养物中生长时会分解抗生素。
如果添加的抗生素不足,或者库存陈旧且浓度不正确,则抗生素选择压力可能不会持续很长时间,您最终可能会获得在大部分培养时间内不含抗生素的培养物。
在没有选择压力的情况下,质粒产量将下降,因为它们使用能量进行复制。
氯霉素:提高质粒产量的简单方法?
许多常用的载体具有松弛的复制起点,这允许将一般蛋白质合成与大肠杆菌中的质粒复制分离。添加氯霉素会停止蛋白质合成,但质粒会继续复制。这将导致每个细菌基因组有更多的载体拷贝。
我所说的松弛源质粒具有 pMB1 或 ColE1 复制起点。具有此起源的最常见的向量主干是(按每个单元的副本的降序排列):
pUC
pGEM
pBR
pACYC - 确保您的衍生物不耐氯霉素,因为这会使添加任何浓度的抗生素无效。
还有更宽松的起源质粒。
有两种方法可以使用氯霉素进行质粒扩增。
1.根据“The Maniatis”使用氯霉素
这是来自 Maniatis等人的经典协议食谱的食谱,又名“The Maniatis”。1
Maniatis 建议将培养物培养至饱和,然后加入 170 µg/ml 氯霉素,并继续培养 16 小时。您将在已经密集的培养物中完全停止蛋白质合成。细胞将停止生长,但载体将继续扩增。
2. 根据 Begbie 的说法,使用氯霉素
贝格比等人。探索了另一种更快的可能性。2在之前的方案中,培养培养物至少需要 36 小时。
当您用发酵剂接种主要培养物时,另一种方法是添加浓度低得多的氯霉素,3 µg/ml。亚抑制浓度会稍微减慢您的大肠杆菌倍增时间,但不会阻止它。但是,它会使您的载体的拷贝数增加数倍。
无论您使用氯霉素扩增载体的方式如何,都将所得培养物视为含有高拷贝数载体。首先,不要用裂解液使中提或大提柱过载——根据方案使用最小培养体积。用最大体积的缓冲液洗脱并重复洗脱。以后您可以随时浓缩 DNA。
6. 裂解和中和问题
Nick详细介绍了碱性裂解,通常中提试剂盒中的这些试剂是稳定且精细的。溶液 2(含有 NaOH 和 SDS 的溶液)会随着时间的推移暴露在空气中而分解,所以如果它是旧的,这可能是一个问题。一般来说,它们用于在试剂盒的整个生命周期内裂解细菌。
人们在质粒制备中犯的最大错误是裂解和中和步骤。该协议通常强调温和以防止基因组 DNA 剪切的重要性,但我发现人们往往 过于 温和。
另一个常见问题是裂解时间过长,导致 DNA 永久变性、无法消化。
以下是改进裂解和中和步骤以及提高质粒产量的一些技巧。
使用低拷贝数质粒?使用双倍推荐体积的重悬、裂解和中和缓冲液。这也可能有助于过去产量低或裂解不良的高拷贝质粒。
加入裂解缓冲液后,代替方案中推荐的 4-6 次倒置,通过连续倒置试管 3 分钟轻轻混匀,然后立即加入中和缓冲液。
通过连续轻轻倒置 1 分钟来混合中和缓冲液。
如果沉淀物看起来像干椰子,那么情况看起来不错。如果它看起来很模糊,这很糟糕。尝试通过混合来打破 gloop,这一次更加剧烈(但仍然非常温和)再持续 1 分钟。
如果glop仍然没有破裂,那么产量可能很差。下次使用如上所述的双缓冲卷。
7. 异丙醇质量
许多实验室将异丙醇装在大型容器中,这些容器已在一年内打开和关闭。为了在沉淀步骤中获得最佳结果,请确保使用的异丙醇不是旧的桶底物质。
使用新瓶或不知道使用了多少年的小瓶中的一些异丙醇。这会对您在离心后获得的 DNA 沉淀的大小产生巨大的影响,从而影响您的质粒产量。要详细了解沉淀的工作原理以及乙醇和异丙醇之间的区别。
8. 失去颗粒
异丙醇颗粒呈玻璃状且透明,很难看到。最佳做法是在管的一侧标记您希望在固定角转子中离心后形成颗粒的一侧,以便在倒出异丙醇时;你知道在哪里寻找它。
使用固定角度转子时,确保您知道颗粒在哪里的另一种方法是以相同的方式(相对于离心机的中心)装载您的试管,然后您的颗粒应该始终在同一个位置。
密切注意现场并寻找玻璃状材料。有时这很困难,因为许多人使用不透明的 Oakridge 塑料管。如果您有玻璃 corex 管,这是一个不错的选择,并且可以烘烤以使其无热原。
有时,如果您担心颗粒会丢失,最好将异丙醇上清液倒入 15 ml 试管中保存,以防颗粒从壁上滑落。但这通常不会发生,只要您在离心机停止后不让样品长时间放置。完成后,就在那里倾析样品。我唯一一次看到颗粒从墙上松动是在我到达离心机时迟到并且它静止了几分钟。
无论您使用 Oakridge 试管还是玻璃,只要注意颗粒应该在哪里。用 70% 乙醇清洗后,颗粒就会变得可见。当您准备好重新悬浮您的颗粒时,您将确切地知道在哪里找到它,因为您标记了试管。
警告!它并不总是一个颗粒!
有时使用固定角度的转子,DNA 可能并不总是在侧壁形成良好的紧密颗粒。它有时会在侧面涂抹。出于这个原因,我总是使用我的重悬缓冲液冲洗我的颗粒上方的墙壁,以确保我溶解每个可能存在的质粒分子,即使我看不到它。
如果您有合适的适配器,您可以使用带有摆动斗式转子的离心机,使您的颗粒全部位于管的底部,而不是侧面。
9. 离心时间太短或太慢
我们在前一篇文章中对DNA 沉淀进行了很好的讨论,一致认为获得高产量的最重要因素是离心速度和时间。除非您可以提高速度,否则不要缩短离心机时间。
10. 列可能会被阻塞
如果您使用离心去除沉淀的碎屑,请在将上清液过滤到 Whatman 滤纸上之前,再将其用于色谱柱,因为少量沉淀物很容易堵塞色谱柱。
11. DNA 未完全洗脱
洗脱后,DNA 可以保留在柱子上。要捕获任何剩余的 DNA,请执行第二次洗脱到单独的集合中。使用加热至 50°C 的洗脱缓冲液也有助于提高洗脱产量。
质粒产量总结
质粒 DNA 制备有很多步骤可能会出错,但根据我的经验,问题通常是培养或 DNA 沉淀。如果您在质粒制备过程中遇到低产量,您可以采取一些步骤。
要检查您的培养物是否适合大规模制备,只需从烧瓶中取出 1-2 毫升,然后快速进行小量制备,看看有多少质粒/毫升。这将使您很好地了解您将从样本的其余部分中得到什么。
所以记住要获得高质粒产量,首先对您的载体和插入做一些背景,以确保 DNA 本身没有任何问题,然后从新鲜的菌落和起始培养物和新鲜的抗生素开始。最后,新鲜异丙醇将是彻底沉淀所有质粒 DNA 的关键。
 文章推荐
文章推荐