
RNA干扰(RNA interference, RNAi)是指在进化过程中高度保守的、由双链RNA(double-stranded RNA,dsRNA)诱发的、同源mRNA高效特异性降解的现象。它是生物进化过程中遗留下来的一种在转录后通过RNA调控基因表达的机制。
历史
1990年,Napoli和Van der Krol等在研究矮牵牛花查尔酮基因时发现了基因共抑制现象(cosuppression)。她在体外构建了控制矮牵牛花花色的基因查尔酮基因片段,连上花椰菜花叶病毒的35S启动子,连入农杆菌的T-DNA质粒,在矮牵牛花中过度表达。她原先预期,查尔酮的过度表达能加深牵牛花花色的紫色,但是结果却导致了矮牵牛花子代花色的褪色,内源性的查尔酮遭到沉默。Napoli教授把这一现象称之为内源性基因共抑制现象。

1995年,Guo等发现注射正义RNA(senseRNA)和反义RNA(antisense RNA)均能有效并特异性地抑制秀丽新小杆线虫(C. elegans)par-1基因的表达,该结果不能使用反义RNA技术的理论做出合理解释。直到1998年,Fire和Mello课题组接手了此课题。他们以秀丽新小杆线虫为模型,发现在Guo的课题中,引发线虫par-1基因沉默的是小片段的双链RNA,而不是正义单链RNA或负义单链RNA。他们之后又研究了秀丽新小杆线虫的unc-22基因,进一步阐述了双链RNA在基因沉默中的作用,并将这一现象命名为“RNA干扰”。他们的研究成果激起了其他科学家研究RNA干扰现象的浓厚兴趣,由于他们的发现揭示了分子生物学中一个全新的,具有普遍性的机制,AndrewFire, Craig C. Mello两位科学家因此在2006年获得诺贝尔奖。
原理
基因沉默分为转录水平的沉默(TGS)和转录后水平的沉默(PTGS)。TGS是指转基因在细胞核内RNA合成受到了阻止而导致基因沉默;对于部分植物来说,转基因引发的基因沉默可能是因为基因特异的甲基化而导致;PTGS则是指转基因能够在细胞核里被稳定地转录,但在细胞质里却无相应的mRNA存在这一现象。目前普遍认为RNAi、共抑制、 quelling均属于PTGS!
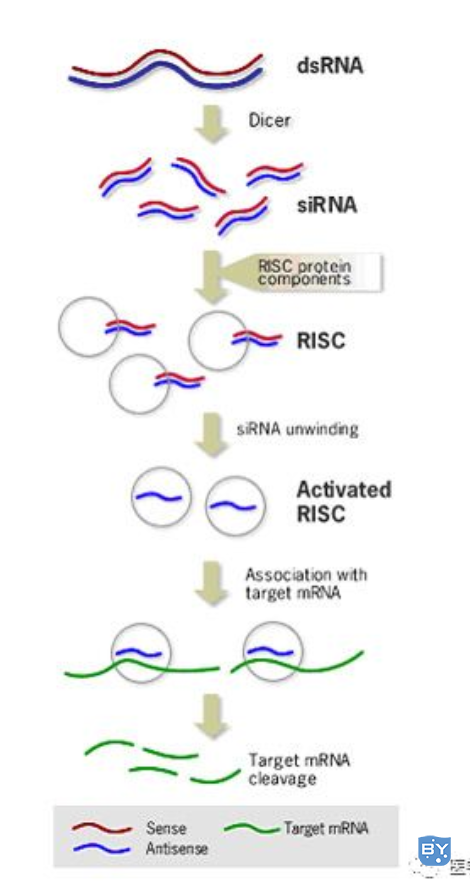
病毒基因、人工转入基因、转座子等外源性基因随机整合到宿主细胞基因组内,并利用宿主细胞进行转录时,常产生一些dsRNA。宿主细胞对这些dsRNA迅即产生反应,其胞质中的核酸内切酶Dicer将dsRNA切割成多个具有特定长度和结构的小片段RNA(大约21~23 bp),即siRNA。研究表明在生物体中siRNA具相似的结构特征:为长约21~23bp的双链RNA,具5’单磷酸和3’羟基末端,互补双链的3’端均有一个2~3nt的单链突出。
负责将dsRNA转化为siRNA的Dicer核酸酶,属于RNaseⅢ家族,具有两个催化结构域、一个解旋酶(helicase)结构域和一个PAZ (Piwi/Argonaute/Zwille)结构域,Dicer在催化过程中以二聚体的形式出现,其催化结构域在dsRNA上反平行排列,形成四个活性位点,但只有两侧的两个位点有内切核酸酶活性,这两个位点在相距约22bp的距离切断dsRNA,各种生物体内Dicer结构略有不同,致使siRNA长度存在微小差别。
siRNA在细胞内RNA解旋酶的作用下解链成正义链和反义链,继之由反义siRNA再与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)。RISC与外源性基因表达的mRNA的同源区进行特异性结合,RISC具有核酸酶的功能,在结合部位切割mRNA,导致特定基因沉默,切割位点即是与siRNA中反义链互补结合的两端。被切割后的断裂mRNA随即降解,从而诱发宿主细胞针对这些mRNA的降解反应。
在RISC中,起靶序列识别作用的是siRNA的反义链,Zamore等发现在RNAi过程中,首先产生的是RISC无活性前体,分子量250kD,当加入ATP后可形成100kD的活性复合体。由无活性前体向活性酶复合物的转换类似蛋白酶原的激活,但RISC酶复合物激活不需要共价键断裂,而要求结合于其上的siRNA双链的解开。在ATP存在时,依赖于ATP的解旋酶解开siRNA的双链并将其正义链与靶mRNA置换,mRNA取代正义链与反义链互补,然后由活化的RISC在互补区的中间,距离siRNA反义链3’末端约12bp处切断靶mRNA序列。
siRNA不仅能引导RISC切割同源单链mRNA,而且可作为引物与靶RNA结合并在RNA聚合酶(RNA-dependent RNA polymerase,RdRP)作用下合成更多新的dsRNA,新合成的dsRNA再由Dicer切割产生大量的次级siRNA,经过若干次的合成-切割循环,RNAi的作用不断放大,最终将靶mRNA完全降解。
SiRNA 设计的原则
1.从mRNA的AUG起始密码开始,寻找“AA二连序列,并记下其3端的19个碱基序列,作为潜在的SiRNA靶位点。有研究结果显示GC含量在30%-50%左右的SIRNA要比那些Gc含量偏高的更为有效。
2.将潜在的序列和相应的基因组数据库(人或者小鼠,大鼠等等)进行比较,排除那些和其他编码序列/ST同源的序列。例如使用BLAST。
3.选出合适的目标序列进行合成。通常一个基因需要设计多个靶序列的 SiRNA,以找到最有效的SiRNA序列。
细胞实验中常用的干扰形式
目前在细胞水平做基因干扰主要有三种方式:siRNA、shRNA质粒和shRNA病毒。其实三种干扰形式最终发挥作用的形式都是siRNA,而后两种都需要用启动子将sh的序列转录成siRNA再去发挥基因干扰的作用。siRNA是通过化学合成的方法直接合成,通过通过转染试剂或者电转直接将siRNA转染进入细胞内发挥作用。shRNA质粒是以质粒的形式通过转染试剂或者电转将质粒转染细胞,质粒进入细胞后通过U6等相关的启动子启动sh的转录,转录为siRNA的形式发挥作用。shRNA病毒是将含有sh序列的质粒包装进入相应的病毒(常用的有慢病毒、腺病毒、腺相关病毒)中,用病毒感染目的细胞,病毒进入目的细胞后sh质粒通过启动子启动sh的转录,转录为siRNA发挥作用。下边是之前整理的三种形式的优缺点1.siRNA随着化学合成的siRNA的价格降低,化学合成的siRNA已经成为目前应用最为广泛的形式。优点:其具有短平快的有优点,发挥作用时间短,价格低,转染操作简单。由于其本身片段只有21bp左右其相对于质粒形式的shRNA来说转染更容易,转染效率更高,对于一些难转染的细胞来时是不错的选择。一般建议转染后24-48小时进行mRNA水平的检测,48-72小时进行蛋白水平的检测。缺点:由于其自身为化学合成的RNA,其具有正常RNA的特性,也容易降解,作用时间比较短,有时候会存在效果不是非常稳定的情况。不能进行真核抗生素的筛选。2.shRNA质粒shRNA 为以质粒形式的存在的RNAi类别,其通常含有一段目的基因的靶序列以及把该靶序列的正义和反义链连接起来的loop环。常用的启动子有U6和H1。优点:shRNA具有所有质粒都有的特点,可以人为的添加GFP等荧光标签,添加puro等真核筛选标签,便于实验中观察细胞的转染效率,如果转染效率达不到要求还可以选择对应的真核抗生素进行筛选。有很小的概率可以整合基因组形成稳定的表达。可以通过原核系统进行扩增,如果是长期使用的靶点可以降低成本。作用时间比siRNA时间更长一些。由于其需要通过启动子启动siRNA的表达所以相应的检测时间要比siRNA略晚。缺点:由于shRNA是以质粒的形式存在,所以对于难转染的细胞来其实验难度就大大提高。基本不能形成稳定干扰的细胞系。3. shRNA病毒优点:其具有shRNA的所有特点,shRNA包装成病毒的形式进行转染细胞,转染效率有相应的提高,如果是慢病毒形式的shRNA还可以整合到目的细胞的基因组中形成稳定干扰的细胞系。其具体的检测时间需要根据不同的病毒类型做相应的调整。缺点:病毒包装周期较长,包装病毒成本相应增高。
 文章推荐
文章推荐