
多色细胞分选是一个复杂的过程,某些科学错误可能很常见。
不成功的多色分类会导致错误的数据和不确定的结果。另一方面,成功的多色分类可以提供出色的结果并得出动态的结论。
成功的多色细胞分选需要特别注意规划。
为您的实验使用特定的设置策略可以为原本复杂的过程创建一个简化的系统。例如,这些用于多色分类实验的关键步骤和策略可以节省您的时间并最大化您的结果。
在设置多色实验时,最常见的错误是未能正确设置 PMT 电压、未能使用活性染料、未能正确识别双峰以及未能设置正确的分选区域和门。消除这 4 个错误对于任何类型的流式细胞术实验都很重要,尤其是对于流式细胞术细胞分选实验。
在设置阶段之前应避免以下4个错误,应在排序之前立即执行。此设置阶段应作为实验计划、优化和试验过程的一部分包括在内,以便为您提供可能的最佳细胞分选结果。
以下是您应该避免的 4 个常见的多色细胞分类错误……
1. 未能正确设置 PMT 电压。
设置多色实验时,最关键的一步是设置 PMT 电压并正确设置。
与流式细胞术中的大多数情况一样,这部分实验设置的首要主题是最大化信号到背景的分辨率。
因此,使用未染色样本设置电压以将负峰置于第一个对数象限(或图中的任何其他所需位置)可能不会,而且通常不会实现最大化每个通道的灵敏度的目标。
请记住,PMT 不会在每个电压设置下都发挥最大作用(即尽可能高效地将光子转换为电子)。此外,为了确保检测器以最佳性能运行,必须使用包含阴性和阳性总体的样本。
未染色样本仅提供关于阴性群体的视角,因此它不能用于确定染色群体与未染色群体的分离程度。
一般来说,当电压设置得太低时,就会出现危险,这可能会导致光电子产生和信号检测不理想。
在细胞倾向于自发荧光的通道中测量信号时,例如光谱的绿色区域,根据未染色的位置设置电压可能会导致 PMT 电压过低。相反,根据红色通道中未染色的位置设置电压,其中细胞自发荧光非常少,可能会导致电压设置得太高,这反过来可能导致阳性群体在完全-获得污点。
如果使用由 FACSDiva 控制的 BD 仪器(例如 FACSAria、LSR II、LSR Fortessa),CS&T 系统可以帮助确定最低基线电压,或该检测器应运行的最低电压。有一些优秀的参考资料提供了广泛而彻底的方法来实现相同的目标。
一般来说,有一些有用的经验法则可以帮助指导您正确设置 PMT 电压的最佳路径。
首先,必须设置电压,以使染色的种群不超出比例。从可视化的角度来看(没有人喜欢查看染色被打碎在比例的高端的数据)和测量角度,这都是至关重要的。标尺的非常高的部分可能不在检测器的线性范围内,并且可能不利于正确的信号测量。同样,这个目标只能通过运行具有明确阳性总体的样本来实现。
小心使用补偿珠来设置电压。
染色可能非常明亮,这可能会导致电压降低到可能不是最佳设置的趋势。在检查以确保没有染色超出比例后,调整电压,通常是通过增加电压,使阳性和阴性群体之间的分离清晰并尽可能最大化。
流式细胞术的一种常见做法是倾向于调整 PMT 设置,以最大限度地减少补偿矩阵中的重叠百分比。请记住,设置电压的主要目标是确保最大化正负之间的分辨率。
重叠百分比并不是分离是否最大化的一个特别好的指标。
只要设置的电压不会超出范围,检测器在线性范围内运行,并且正负分离良好,不必担心补偿百分比,假设补偿设置正确。相反,让数据自己说话。
始终确保每个控件的 PMT 电压相同。如果所有通道中的电压在控件之间不一致,则无法正确计算补偿。
2. 没有使用活性染料。
抗体倾向于粘在死细胞上,这将导致可能严重影响纯度的假阳性。
这对于一种分类来说可能是毁灭性的,尤其是当细胞将用于依赖高完整性分类纯度的下游分子应用时。此外,虽然分选部分中的假阳性死细胞可能不会在基于细胞的测定中生长,但它们的存在可能会影响存在的其他细胞的细胞过程。
活性染料有很多不错的选择,并且有两种机制不同:DNA 结合染料和胺反应性染料。
DNA 结合染料,如碘化丙啶 (PI)、DAPI 和 7-AAD,通常是带正电荷的分子,具有很强的 DNA 亲和力,不能穿过完整的细胞膜。因此,它们只对细胞膜受损的死亡或垂死细胞的 DNA 进行染色。这些染料是不错的选择,因为染色速度非常快,因此可以在分拣前很快添加染料,不需要单独的染色步骤。
由于染色剂在缓冲液中过量存在,DNA 结合染料提供了细胞死亡的“实时”指标。在分选过程中死亡的细胞将允许染料进入细胞核并开始发出荧光。
虽然通常不考虑分选,但这些染料不能与固定细胞一起使用,因为染料-DNA 结合是非共价和平衡驱动的。
如果细胞在染色后被固定,与固定前死亡细胞中的DNA 分离的染料可能会染色固定前活细胞的 DNA,因为固定会破坏细胞膜的完整性。或者,胺反应性染料,通常称为“可固定”染料,与细胞表面和细胞内的游离胺共价结合。必须在独立的染色步骤中使用这些染料进行染色。
染料会进入并染色死细胞和膜受损的细胞,因此死细胞的染色强度将远高于活细胞,这允许染料仅与细胞表面的那些胺结合。染色后,如果需要,可以固定细胞,因为染料-胺键是共价键而不是平衡驱动的,因此固定后染色完整性将保持不变。
一般来说,DNA 结合染料比胺活性染料更适合用于分选,因为它们易于使用和“实时”特性,因此在设计面板时坚持使用这些可用的多种选择。
试剂制造商设计了多种口味的 DNA 结合活力,因此找到适合您的面板的应该不是一项艰巨的任务。ThermoFisher 制造的 SYTOX Ⓡ染料是一个不错的选择。
一件好事是将活性染料与转储通道或用于筛选标记或多个标记呈阳性的细胞的通道相结合,例如从分析中去除“谱系阴性”细胞。由于转储染料通道和活力染料通道都用于排除被染色的细胞,因此两者都可以组合到一个通道中,从而可以腾出细胞仪上的另一个通道用于另一个标记。
3. 无法区分双胞胎和单胞胎。
当两个细胞通过询问点时,会发生双峰,因为它们靠得很近,以至于仪器将它们视为一个事件。
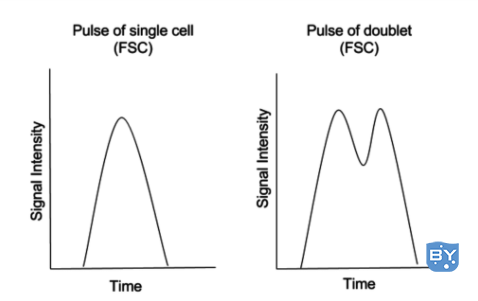
发生这种情况时,在 FSC 检测器中测量的双峰事件的脉冲如下图所示。
双峰脉冲的高度通常等于单粒子脉冲的高度。
但是,由于双重脉冲本质上是两个单粒子脉冲的合并,所以这样的脉冲的面积和宽度会比单粒子脉冲更大。我们可以利用单粒子和双峰信号脉冲参数的差异来区分两者。
通常,面积相对于高度绘制,高度相对于宽度绘制,或者面积相对于宽度绘制。所有细胞必须在所选参数中具有可测量的信号,因此通常使用前向散射或侧向散射。
此外,可以包括两个双峰识别门,一个使用 FSC,另一个使用 SSC,以实现更稳健的双峰识别。虽然双峰鉴别对于任何类型的流式细胞术实验都很重要,但对于细胞分选尤为重要。
未能将双联体与单细胞区分开来会严重影响多色细胞分类的纯度。
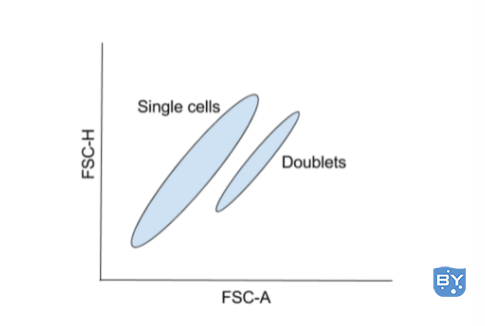
双峰事件可以包含一个满足排序逻辑的单元和另一个不满足排序逻辑的单元。因为分选器已将这两个单元格识别为一个事件,所以整个事件(目标单元格和非目标单元格)都将被分选,从而在收集部分中产生目标和非目标单元格。
双峰的存在并不一定表示分拣机的性能不佳。
双峰事件是流式细胞术实验的正常和预期方面,其频率取决于细胞如何分散到流中。更密集的悬浮液和贴片细胞类型肯定会影响分散,因此如果观察到双峰,请不要感到沮丧。最重要的是找到并消除它们。
4. 没有设置正确的排序区域和门。
设置正确的分拣区域和门对于分拣尤为重要,因为在分拣开始之前所有设置都必须完美,才能获得最高水准的结果。应根据FMO 控制确定的阳性边界设置门,以确保仅分选真正的阳性细胞。
请记住,流式细胞仪中的种群是具有固有方差或宽度的分布。
群体的宽度主要是与细胞结合(免疫荧光)或由细胞(荧光蛋白)表达的荧光团数量以及测量变化的函数。通过细胞仪 1,000 次的单个理论细胞的荧光每次将被不同地测量,并会产生其自己的“种群”。
这种情况的程度取决于许多因素,包括激光功率、仪器的收集效率和检测波长。人口在对数尺度上的下降越低,这种错误就会越多地被揭示出来,就像补偿揭示的错误导致溢出扩散一样。
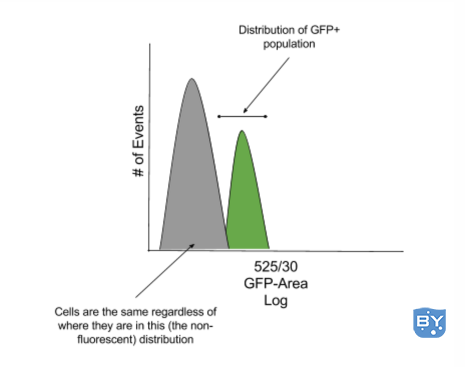
对数尺度上较低的十年包含的 bin 或荧光强度值少于对数尺度上较高的几十年,因此具有相同方差的分布在对数尺度的第二个十年看起来比第三个十年更宽。
在上面的示例中,GFP+ 种群与 GFP- 种群非常接近,并且两个种群重叠。
因此,在这种情况下,将事件分类为 GFP+ 的区域距离阴性群体足够远,以确保没有 GFP- 细胞因测量不精确而落入 GFP+ 区域,这一点至关重要。此外,阴性群体的分布不反映任何荧光信号,并且细胞落在该分布中的位置没有意义。
在大多数情况下,假设阴性群体中所有细胞的自发荧光相同,则阴性分布左侧的细胞与分布右侧的细胞没有区别。因此,如果分类区域包含非荧光种群的特定部分,则不要期望“纯”种群。
当再次通过仪器进行纯度检查时,将重新填充整个阴性分布,因为未染色细胞之间在刻度上的出现位置绝对没有差异。
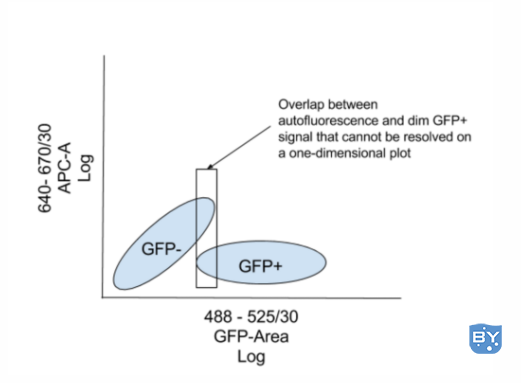
作为提示,在二维点图上比在直方图上区分暗淡的 GFP 信号和背景通常更好,如下图所示。
通过将 GFP 或任何其他信号与实验中未使用的另一个参数作图,可以将低表达细胞与非表达细胞的自发荧光区分开来,因为这些细胞是如何分布的两个通道,如上图所示。
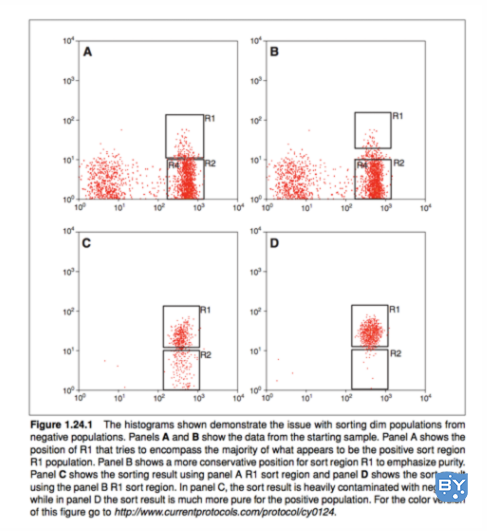
下图来自 Arnold 和 Lannigan,清楚地强调了在信号微弱时保守设置分类门的重要性。不这样做会通过允许非表达细胞进入分类区域而严重影响纯度。
上图来自Arnold 等人在Current Protocols in Cytometry上发表的一篇论文。在这里,面板 A 和 C 显示了当分类门 R1 放置得太靠近阴性群体 (R2) 时的效果。因为这个门侵犯了负分布,所以它不能区分非表达细胞和表达细胞。使用此门的纯度很差。
当分拣门的位置更保守时,纯度会更高。
在为模糊表达的细胞设置门时请记住这一点。它可以区分成功排序和次优排序。
多色流式细胞仪分选实验虽然有时具有挑战性,但并非不可克服。在设置多色实验时,最关键的一步是正确设置 PMT 电压。此外,使用活性染料并解决双峰鉴别问题并设置正确的分选区域和门对于任何类型的流式细胞术实验都很重要,尤其是对于细胞分选。利用此处描述的技巧以及可用于帮助优化多色染色的大量其他资源,应该有助于阐明设置和执行此类细胞术实验的一些更困难的方面。
 文章推荐
文章推荐