
免疫组化是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂 (荧光素,酶,金属离子,同位素) 显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位,定性及定量的研究,称为免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry).
免疫组化的作用是什么呢?
由于免疫组化具有特异性强、灵敏度高、定位准确等特点,且能将形态研究与功能研究有机地结合在一起,所以,这门新技术已被广泛地应用于生物学和医学研究的许多领域。在病理学研究中,免疫组化技术的作用和意义更为重要。以肿瘤研究为例,在免疫组化技术出现以前,对肿瘤的诊断和分类还局限于细胞水平,而引入免疫组化技术后,则使研究的深度提高到了生物化学水平、分子水平。近年来,伴随基因探针研究而兴起的核酸分子原位杂交技术也正在蓬勃发展,更使免疫组化如虎添翼,两者相得益彰,将研究推进到了基因水平。
免疫组化实验步骤
固定
固定的目的是为了使蛋白质凝固,减少或终止内源性/外源性细胞内分解酶的反应,防止组织细胞自溶,保存组织或细胞内的抗原性。现在常用的固定剂有中性甲醛液,4%多聚甲醛-磷酸盐缓冲液。有些固定剂对特殊组织有更好的效果,如苦味PLP固定液对于含糖组织保存更好,Helly固定液对于胰岛和垂体效果较好等。
脱水、石蜡包埋和制片
脱水用梯度乙醇(由低到高)充分脱水,对于一些易脆的组织应减少高浓度酒精里的停留时间,透明的时间也应该控制缩短。对组织浸蜡时,一般选用56℃-58℃熔点石蜡,浸蜡温度最好不超过60℃,防止抗原的损失。包埋时应果断迅速,切片时注意检查刀片是否出现缺口,防止;蜡带出现裂痕。
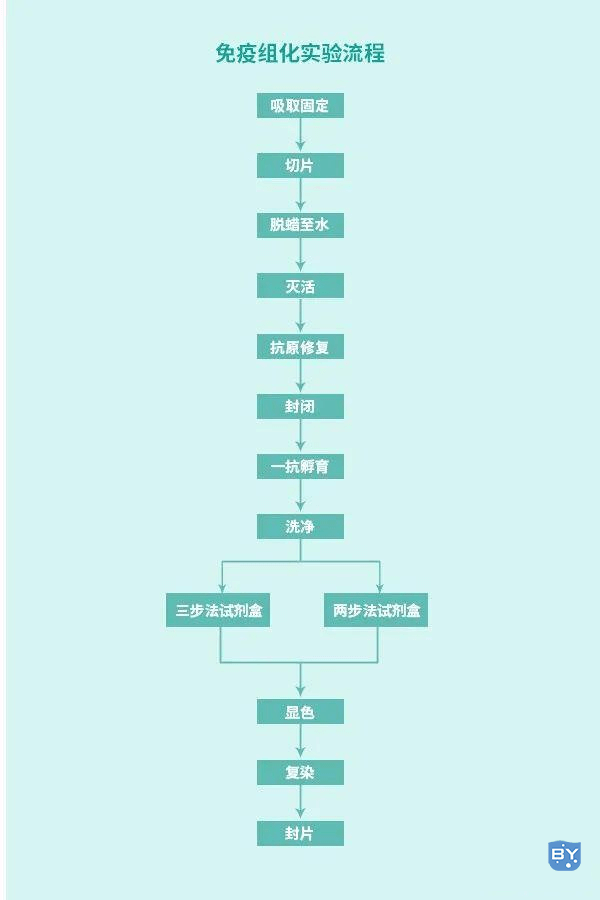
脱蜡和水化
使组织恢复到固定后的正常状态暴露抗原,方便与一抗结合。若脱蜡与水化不完全易出现局灶性反应和浸洗不完全,产生非特异性背景着色。
抗原修复
由于组织在甲醛或多聚甲醛在固定中,发生蛋白之间交联及醛基的封闭作用,从而掩盖抗原决定簇。通过抗原修复,使得细胞内抗原决定簇重新暴露,提高抗原检测率,常用方法通常使用高压加热修复,使用高压加热修复对修复温度和时间的把握十分重要,温度越高修复时间越短,温度与修复时间呈负相关。修复结束后注意室温冷却,让蛋白自然复性。另外,大家尽量使用过量的抗原修复液,防止高温液体挥发干涸,对切片造成不可逆影响。
标本固定
传统的免疫组化法容易受到内源性过氧化物酶和生物素的干扰,必须对其进行灭活和封闭。灭活内源性过氧化酶一般用3%过氧化氢灭活10min左右,用甲醇配制过氧化氢更适合于保护抗原和固定组织。
血清封闭
血清封闭的目的是为了一抗与组织的非特异性结合,造成假阳性,一般会采用BSA、羊血清等封闭这些位点,封闭血清一般是和二抗同一来源的,室温封闭10-30min。
一抗和二抗浓度和孵育时间
不同的一抗浓度,孵育时间和温度等对染色结果往往有较大的影响。在4℃下,反应缓慢,背景较浅;而37℃反应较快,时间较短;室温介于两者之间,二抗一般室温孵育30min。
DAB显色
检测背景的深浅和特异性染色的深浅基本上都以DAB孵育条件决定。DAB的显色时间并不是固定的,主要方法是使用显微镜控制显色时间,到出现特异性染色较强且出现背景着色较浅时就可以冲洗。如果DAB显色时间过长(超过十分钟)才出现阳性染色,可能是一抗体浓度过低或者封闭时间过长,也可以加入金属离子来增强显色(如硫酸铜、氯化钴、硫酸镍铵等);如果DAB显色时间过短颜色就很深,这可能是一抗过高,需要下调抗体浓度,如果短时间内过深。
复染
免疫组化染色后为了衬托出组织形态结构有必要进行复染,常用试剂为Mayer’s苏木染色,一般为2 min左右,DAB在核蛋白着色的时间可以适当缩短,最后用氨水或PH 8.0的TBS返蓝。
封片
在封片阶段我们通常是用中性树胶来进行,封片过程中注意斜靠盖玻片防止气泡的产生从而对结果进行营影响,建议最好在通风橱操作,这样有利于气泡排除干净,不影响后续的镜检。
 文章推荐
文章推荐