
细胞周期指细胞一个世代所经历的时间。从一次细胞分裂结束到下一次分裂结束为一个周期。细胞周期反映了细胞增殖速度。细胞周期是一个重要的检测参数,研究细胞周期变化的影响对于肿瘤的发展及药物研发有着重要的作用。例如,已知抑制有丝分裂的化合物大都用来减缓肿瘤细胞的生长。
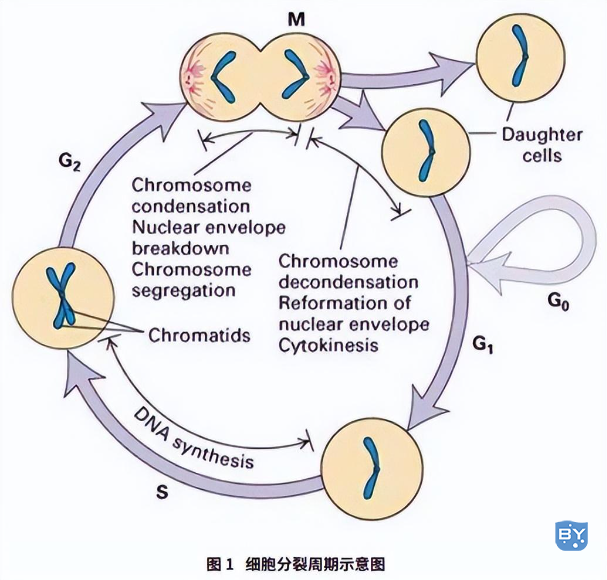
细胞周期内有两个阶段最为重要:G1 到 S 和 G2 到 M;这两个阶段正处在复杂活跃的分子水平变化的时期,容易受环境条件的影响,如果能够人为地进行调控,将对深入了解生物的生长发育和控制肿瘤生长等有重要意义。能够方便有效地检测细胞周期的变化,对于药物研发和疾病研究等都具有重要的意义。
单个细胞的周期测定可采用缩时摄影的方法,但它不能代表细胞群体的周期,故现多采用其他方法测群体周期。
那么,细胞周期的测定如何进行的呢?测定细胞周期的方法很多,有同位素标记法、流式细胞仪法、基于细胞成像的荧光检测法等。
一、同位素标记法测定细胞周期
标记有丝分裂百分率法 (PLM) 是一种常用的测定细胞周期时间的方法。其原理是对测定细胞进行脉冲标记、定时取材、利用放射自显影技术显示标记细胞,通过统计标记有丝分裂细胞百分数的办法来测定细胞周期。
测定原理:
① 待测细胞经 3H- 胸腺嘧啶核苷标记后,所有 S 期细胞均被标记。
② S 期细胞经 G2 期才进入 M 期,所以一段时间内 PLM = 0。
③ 开始出现标记 M 期细胞时,表示处于 S 期最后阶段的细胞,已渡过 G2 期,所以从 PLM = 0 到出现 PLM 的时间间隔为 G2期的持续时间。
④ S 期细胞逐渐进入 M 期,PLM 上升,到达到最高点的时候说明来自处于 S 最后阶段的细胞,已完成 M,进入 G1 期。所以从开始出现 M 到 PLM 达到最高点 (≈ 100%) 的时间间隔就是 M 期的持续时间。
⑤ 当 PLM 开始下降时,表明处于 S 期最初阶段的细胞也已进入 M 期,所以出现 LM 到 PLM 又开始下降的一段时间等于 S 期的持续时间。
二、流式细胞仪 PI 染色法
细胞周期分为间期与分裂期两个阶段。间期又分为三期:即 DNA 合成前期 ( G1 期 )、DNA 合成期 ( S 期 ) 与 DNA 合成后期 ( G2 期 )。某些细胞在分裂结束后暂时离开细胞周期,停止细胞分裂,执行一定生物学功能 ( G0 期 )。
检测细胞周期的原理:
由于细胞周期各时相的 DNA 含量不同,通常正常细胞的 G1 / G0 期具有二倍体细胞的 DNA 含量 ( 2N ),而 G2 / M 期具有四倍体细胞的 DNA 含量 (4N),而 S 期的 DNA 含量介于二倍体和四倍体之间。PI可以与 DNA 结合,其荧光强度直接反映了细胞内 DNA含量。因此,通过流式细胞仪 PI 染色法对细胞内 DNA 含量进行检测时,可以将细胞周期各时相区分为 G1 / G0 期,S 期和 G2 / M期,获得的流式直方图对应的各细胞周期可通过特殊软件计算各时相的细胞百分率。
三、基于成像的荧光检测法
FUCCI (fluorescent ubiquitination-based cell-cycle indicator) 小球能鉴别细胞处在细胞周期的哪一时期,因此可以用来研究癌症细胞周期的进程。FUCCI 技术建立在鉴定过表达的两种调节细胞周期的蛋白 geminin 和 Cdt1 水平上,其中 geminin 融合的是绿色荧光基团 AmCyan,而 Cdt1 融合的是红色荧光基团 mCherry。Cdt1 和 geminin 的水平随着细胞周期的变化而不断波动:Cdt1 蛋白水平在 G1 阶段达到峰值,而 geminin 蛋白水平在 S,G2 和 M 期不断升高。这一结果体现为表达 FUCCI 细胞核在G1 期为红色而在 S,G2 和 M 期则呈现绿色 ( 图 2 )。
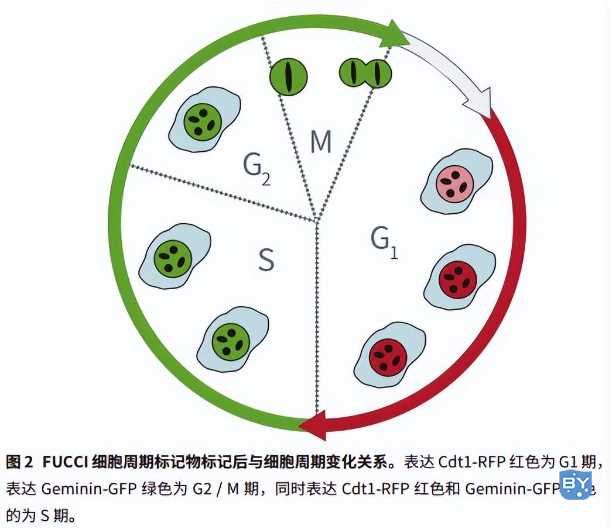
1 检测方法
A375S FUCCI 球体准备的方法如下:Corning 公司 96 孔 U 型底低吸附细胞培养板中加入含有 EGF (20 ng / mL) 和 B27 (1×)的 DMEM / F 12 培养基,按每孔 1,000 细胞进行种板。细胞板离心 (800 g,6 min) 后在 37 ℃,5% CO2条件下进行孵育。最后,用含 10% FCS 的培养基清洗球体 3 次以移除 EGF 和 B27,继续培养 1 至 6 天。
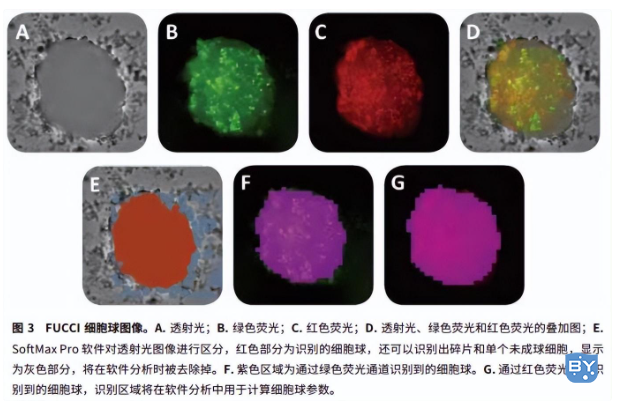
2 数据分析
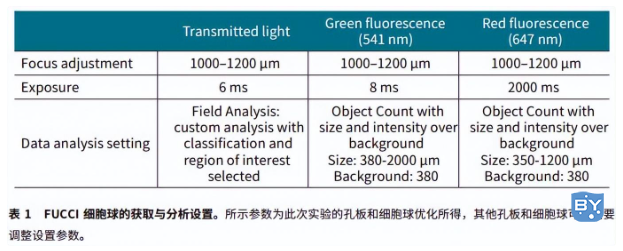
MiniMax 细胞计数仪的透射光模块可以从自动聚焦得到更好的图像效果。SoftMax Pro 软件中的“Field Analysis”能进行自定义分析从而鉴别细胞重叠的部分。我们应用一种特殊的鉴别方法来区分目标球体和其余物体,如残渣和个体细胞,从而在后续的分析中予以去除 (Figure 2, A and E)。最后,我们选择感兴趣的区域并从图像中去除不想要的物体。在绿色和红色荧光通道中,球体可以通过“Object Count”模式中大小和与背景相对荧光强度的区别被轻易的筛选出来 (Figure 2, B-D, F-G)。然后运用SoftMax Pro 软件计算图像的“% Area coverage”和球体的“Object Area” (μm2)。图像的获取和分析的设置方法见表 1。
3 结果
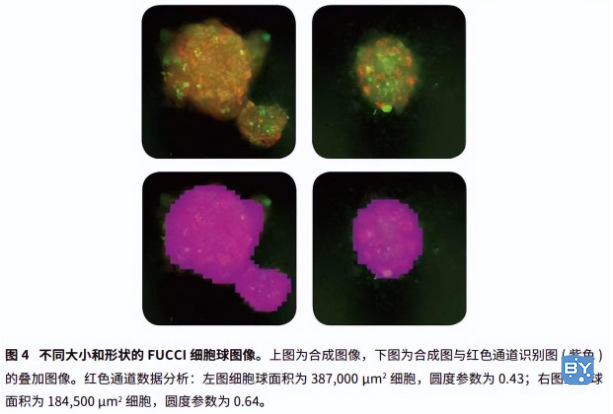
SoftMax Pro 软件中获取及分析的设置可以在绿色和红色荧光通道的透射光下简便快速地分辨每个孔中的单球体。SoftMax Pro软件还可计算所有通道包含的面积占比和物体面积 (μm2) (图 3,表 2)。在绿色和红色荧光通道下可以获得最好的结果。对于 FUCCI 球体来说,图 3 中红色部分展示的是光滑圆润的球体而绿色部分则在细胞表面,说明球体内部的细胞处在 G1 期而表面细胞即将进入 M 期。对应软件可以分辨球体大小和形状 ( 球形参数 ) 的各种变化,因此常用来研究多种处理,如抗癌药物,对细胞增殖的影响 ( 图4 )。MiniMax 中绿色和红色荧光的光学成形功能可以将 3D 图像转换为 2D 投射球体图。
四、高内涵检测法
方法
1. 准备细胞悬液,40,000 细胞 / mL 的 Hela 细胞悬液与 30 颗粒 / 细胞浓度的 FUCCI 试剂混合,以 4,000 细胞 / 孔的浓度种在 96 孔板中,孔板置于 37 °C,5% CO2 的环境下贴壁 8 小时。
2. 不同浓度的有丝分裂抑制剂处理细胞,然后孔板放入 ImageXpress Micro 系统。
3. 每隔 2-3 小时系统自动拍摄一次图片,使用 20 倍 Plan Apo 物镜,同时获取明场及两个荧光通道 FITC 和 TRITC 的图像。实验持续 48 - 72 小时,细胞可完成 1 - 2 次分裂。
4. 分析延迟实验图像使用 MetaXpress® 高内涵成像与分析软件的用户自定义模块。
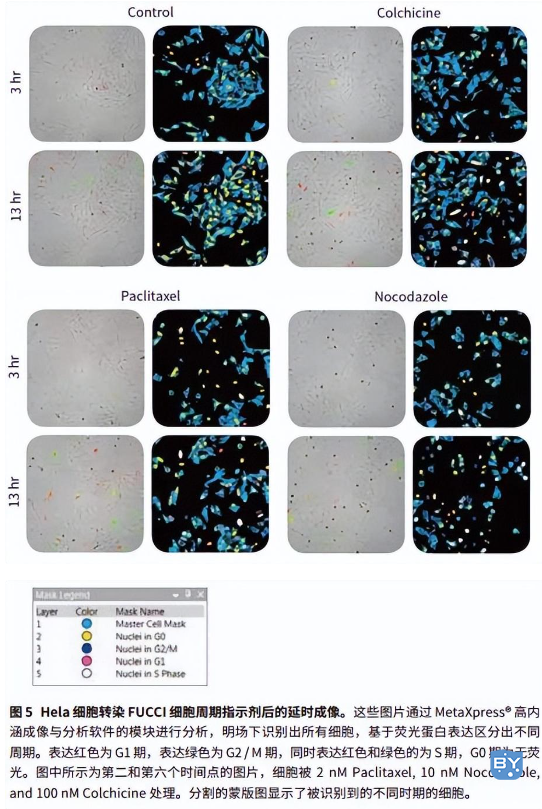
Premo® FUCCI 细胞周期指示剂结合配置环境控制的 ImageXpress Micro 高内涵成像系统和 MetaXpress 高内涵分析软件,可实现高效的活细胞周期精确测量。高通量筛选技术可为科学家提供一个快速、自动的基于图像定量分析细胞周期的方法,并能够完整地记录长时间内的细胞周期变化。另外,MetaXpress 软件能够在明场图像识别细胞,避免了染料对活细胞的毒性。同一标准具有统计学意义的定量分析方法可评价多化合物在不同浓度对细胞周期影响的相关参数。
 文章推荐
文章推荐