
做肿瘤研究的人,很少有不知道 transwell 实验的,它是用来研究肿瘤细胞的迁移侵袭转移情况的一种简便快捷的实验方法,还可以构建两种细胞的共培养体系以及趋化性试验。今天咱们就来讲讲怎么做肿瘤细胞的侵袭转移实验。
Transwell 侵袭实验,其实原理简单地说就是用一层膜将高营养的培养液和低营养的培养液隔开,细胞放在低营养的培养液里,为了找吃的,细胞会往高营养的培养液里面跑,但是有膜挡着,所以要穿过膜才行。
我们在膜上涂上一层基质胶,模仿细胞外基质,于是细胞就要分泌金属蛋白酶将基质消化了才可以从低营养的培养液跑到高营养的培养液里面,最后我们检测高营养的培养液里细胞量就可以知道细胞的侵袭能力了。而迁移实验就是不铺胶直接让细胞穿过就行了。
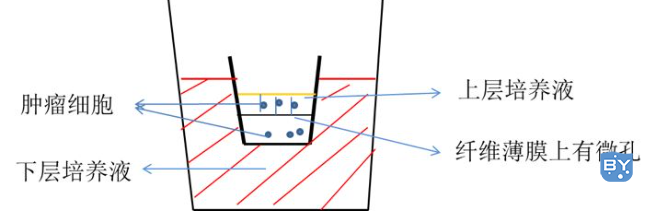
Transwell 简易图
以下学霸君来介绍侵袭实验步骤:
实验前准备:transwell 小室(一般选用 12um),24 孔板,基质胶(corning),细胞实验所需的基本的材料。
1
基质胶铺板
用 BD 公司的 Matrigel 1:8 稀释(可以直接用无血清的培养基稀释),包被 Transwell 小室底部膜的上室面,置 37℃孵箱 1-4h 使 Matrigel 聚合成凝胶(时间不宜太长,之前有人说在 37 度孵箱过夜,反正元元师兄觉得不太可能)。
注意事项:
1. 铺胶之前将枪头以及所用的耗材至于冰箱 4 度当中,否则配胶的时候会直接凝固。
2. 铺胶的厚度自己摸索,25ul,40ul,100ul。
3. 注意铺胶过程不要产生气泡,铺胶均匀,否则影响实验结果。
4. 注意无菌操作。
2
制作细胞悬液
1. 制备细胞悬液前可先让细胞撤血清饥饿 12-24h,进一步去除血清的影响。但这一步并不是必须的。
2. 消化细胞,终止消化后离心弃去培养液,(用 PBS 洗 1-2 遍,这一步很必要,否则细胞表面覆有血清培养基,细胞没有迁移侵袭的动力),用无血清培养基重悬。
3
接种细胞
1. 细胞悬液 200µl 加入 Transwell 小室(肿瘤细胞数目需要摸浓度,从 2 万,5 万,10 万)。
2. 24 孔板下室一般加入 600µl 含 15%FBS 的培养基,特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失。在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。
3. 养细胞:常规培养 12-48h(主要依癌细胞侵袭能力而定)。24h 较常见,时间点的选择除了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。
4
固定染色
取出 Transwell 小室,弃去孔中培养液,用无钙的 PBS 洗 2 遍,用棉签轻轻擦掉上层未迁移细胞,甲醇或者甲醛固定 30 分钟,将小室适当风干。用 0.1% 结晶紫染色 30-60 min,用 PBS 洗 3 遍。用棉签轻轻擦掉上室水分。
5
计数
400 倍显微镜下随即五个视野观察细胞,记数。
如果细胞怎么还是穿不过去。总结一下几个原因:
1. 细胞不具备侵袭转移的能力(例如 MCF7 为非转移性的细胞)
2. 基质胶铺的太厚了 (基质胶的稀释倍数是可以改的,基质胶的量是可以摸的)
3. 细胞给的量太少了(200ul 里 2 万细胞太少,给 5 万,10 万,20 万呗)
4. 细胞没有进行预处理(这步可以免),也没有用 PBS 洗两遍 (这一步不可省,因为你用胰酶消化后,含血清的培养基中和,必须洗干净了。
5. 上层的培养基为无血清培养基,下室的培养基为 15% 的血清培养基,这个浓度可以改成 20%,细胞数不够,底下的吸引力也不够不行哈。
6. 细胞的活性太差,半死不活的细胞做侵袭实验伤不起哈。
所以,以后穿不过去,可以考虑增加细胞量,减少基质胶量,提高下室血清浓度。
 文章推荐
文章推荐