
肾上腺由两个组织组成,皮质和髓质,结合在一个胶囊下。肾上腺干/祖细胞在发育和体内平衡中起着关键作用。今天我们分享一下从小鼠中分离和体外培养肾上腺细胞的实验操作与注意事项。
从Netin-GFP小鼠中分离和分化肾上腺皮质和肾上腺素干细胞和祖细胞。这个方案也可用于分离其他肾上腺细胞和其他小鼠菌株。请参阅下面的实验设计图,确定哪种实验设计适合您。比如,如果您对干细胞和祖细胞没有兴趣,则可以通过跳过步骤3(增殖)来培养分离和完全分化的细胞。
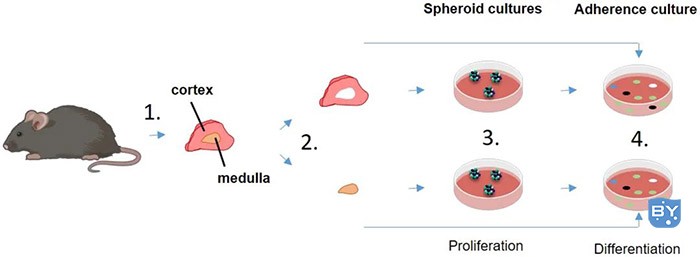
图1:该图表显示了完整的方案:(1)分离肾上腺,(2)将肾上腺分离成皮质和延髓,(3)干细胞样细胞的球状培养物,(4)分化成成熟的肾上腺细胞。
在开始分离肾上腺细胞之前,请注意,您需要获得进行动物实验的许可。
一
准备工作
1、准备四个装满PBS的小培养皿(60×15毫米),将它们放在冰上
2、准备用于解剖的工具:镊子和剪刀
3、制备消解缓冲液并预热至37°C
4、准备培养基并将其预热至37°C
注意:
对于一个实验,20 mL培养基通常就足够了。对于长期培养,必须每周制备一次新鲜培养基。bFGF应始终在使用前添加。同时,注意无菌操作!
图2
二
收集肾上腺
解剖小鼠并收集肾上腺。我们通常在大约8周的年龄从两性中的10只小鼠中分离肾上腺细胞。然而,肾上腺细胞可以从所有年龄段的小鼠中分离出来,但是,当小鼠小于3周时,肾上腺的解剖变得非常困难。
1、为了避免污染,在小鼠的皮毛(腹部)上喷洒乙醇消毒。
2、通过从底部到顶部(颅骨)的中间(白线)切开腹壁,直到隔膜的开始(图3A)。
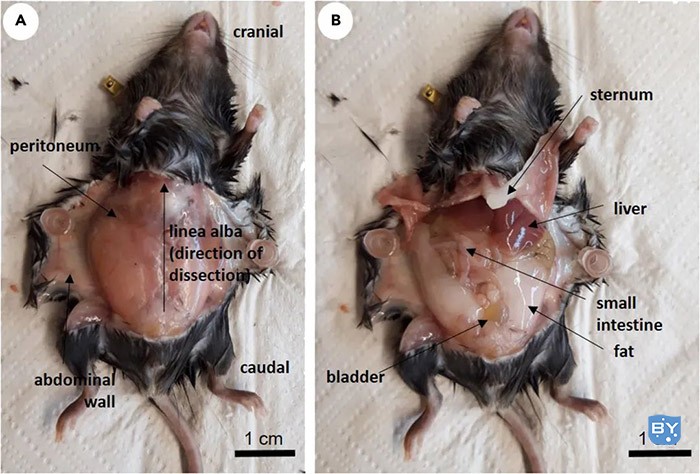
图3.小鼠解剖,A、小鼠打开腹壁后;B打开腹膜后的小鼠
3、通过在前一个切口的顶部(颅骨)和底部(尾部)末端进行右切和左切来制作创口。
4、以与之前腹壁相同的方式打开腹膜(图3B)。
5、为了切除右侧肾上腺,将所有器官(肠,肝)非常小心地放在左侧。
注意:避免解剖其他器官和血管。如果出血,可能很难找到肾上腺
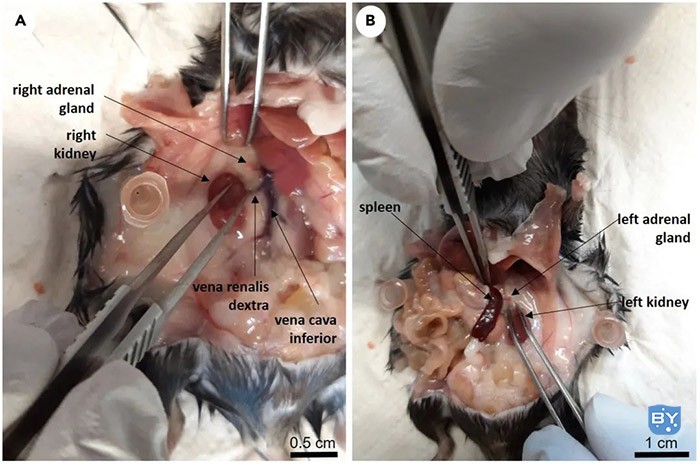
图4.肾上腺位置(A)右肾上腺;(B)左肾上腺。
6、小心地抬起肝脏的左侧,使右肾和肾上腺可见。
7、通过用弯曲的镊子抓住腺体周围的一些脂肪而不挤压腺体本身来解剖肾上腺。
注意:如果小鼠有很多脂肪(图3B),请注意不要解剖静脉或/和动脉。
8、将肾上腺放入含有PBS的培养皿中冰上。
9、为了切除左肾上腺,将所有器官非常小心地放在右侧(图4B)。
10、小心地抬起胃和脾脏,使左肾和肾上腺可见。
11、通过用弯曲的镊子抓住腺体周围的一些脂肪而不挤压腺体本身来解剖肾上腺。
12、将肾上腺放入培养皿中,PBS已经含有正确的肾上腺。
13、用剩余的小鼠重复解剖步骤,并将所有肾上腺聚集在一个培养皿中。
14、为了摆脱潜在的杂质和血液,使用弯曲的镊子小心地将所有肾上腺转移到带有PPBS的新培养皿中。
三
脂肪去除和分离皮质和髓质
经过练习操作,脂肪可以在每个肾上腺1-2分钟内去除。手动分离成皮层和延髓的情况也是如此。但是,前几次,可能需要更长的时间。以下步骤应使用立体显微镜执行。
1、小心地去除肾上腺周围的脂肪。脂肪可以剥离并丢弃在培养皿旁边的纸巾上。
注意:有些人更喜欢使用手术刀而不是手术刀。但是,根据经验,在使用镊子时,您可以更好地控制。
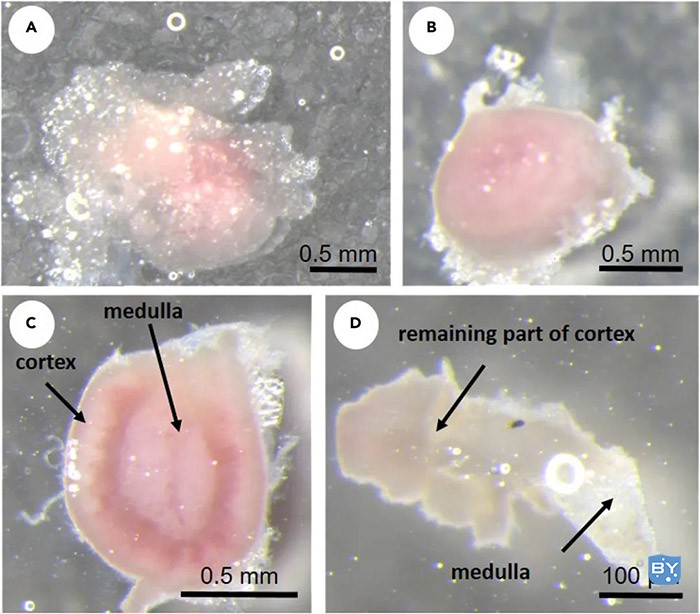
图5.脂肪去除和皮质和延髓的分离 A)肾上腺有脂肪。B)从肾上腺去除脂肪。C)开放的肾上腺。D)髓质与皮层分离。
2、将清洁的肾上腺放入装满PBS的新培养皿中。继续使用剩余的肾上腺,并将它们全部收集在同一培养皿中(图5B)。
注意:不要用镊子握住肾上腺,同时不要压缩和损伤肾上腺。
3、将培养皿和所有清洁的肾上腺放在立体显微镜下。打开肾上腺的一侧,尝试一点一点地剥离皮层。延髓是可见的,但PBS越不清晰,皮质剥落越多(图5C)。
注意:如果PBS变得太不清晰,剩余的肾上腺可以转移到PBS的新培养皿中,然后在以后再次合并。
4、使用镊子时,要小心地将延髓转移到充满PBS的新培养皿中(图5D)。皮质组织碎片保留在立体显微镜下的培养皿中。继续使用剩余的肾上腺。
注意:由于延髓非常小,因此始终关注它很重要。否则,可能很难将其与皮质组织片段区分开来。
四
消化和细胞分离
1、将培养皿(分别为皮质和髓质)的内容物转移到一个50mL管中。使用1000μL移液器。
注意:纸巾可能会粘在移液器尖端的内侧。尝试上下移液以取出剩余的组织。
2、在室温(20°C-25°C)下以270×g离心5分钟。
3、使用1000μL移液管除去并丢弃PBS上清液。
4、将5mL消化缓冲液分别加入分别含有皮质和延髓的50mL管中。
5、在37°C的振荡水浴中放置20分钟。
注意:髓质细胞比皮质细胞更敏感。因此,不要消化这些细胞超过20分钟是非常重要的。对于皮质细胞,30分钟也可以。
6、取出50 mL试管,并使用1000μL移液器上下移液∼50次,重悬剩余的组织部分。
7、在室温下以270×g离心5分钟。
8、洗涤步骤:
a、从两个50mL管中取出并丢弃上清液。
b、向每个50 mL试管中加入5 mL PBS。
c、在室温下以270×g离心5分钟。
9、髓质细胞:
a、取出并丢弃上清液。
b、用bFGF将细胞沉淀重悬于500μL培养基中。
c、将悬浮液加入孔径为100μm的简单过滤器中。
d、再向过滤器中加入500μL以使所有细胞通过。
10、皮质细胞:
a、多次进行洗涤步骤:取出并丢弃上清液。
b、向每个5 mL试管中加入50 mL PBS。
c、在室温下以270×g离心5分钟。
d、取出并丢弃上清液。
e、用bFGF将细胞沉淀重悬于500μL培养基中。
f、将悬浮液加入孔径为100μm的简单过滤器中。
g、再向过滤器中加入500μL以使所有细胞通过。
11、将每个细胞悬浮液接种在一个24孔板的超低附着表面的孔中。
12、在培养箱中培养细胞16-24小时(37°C,5%CO2)。
13、通过使用1000μL移液器将细胞转移到15mL管中来更换培养基,并将细胞以270×g离心5分钟,除去旧培养基并将细胞重悬于含有bFGF的新鲜细胞培养基中。将细胞转移到24孔板的新孔中。
注意:根据合并的小鼠/肾上腺的初始量,可能需要在第一次培养基更换时将皮质细胞分离成2-3个孔。在我们的实验中,我们主要使用10只小鼠,在这里我们在24孔板上为3个孔分离足够的皮质细胞。髓质细胞保持在一个孔中。
14、通过仔细除去一半培养基并加入相同量的新培养基(总共1 mL /孔)含有bFGF,每3-4天进行一次培养基更换,在球状培养物中培养细胞长达4周。
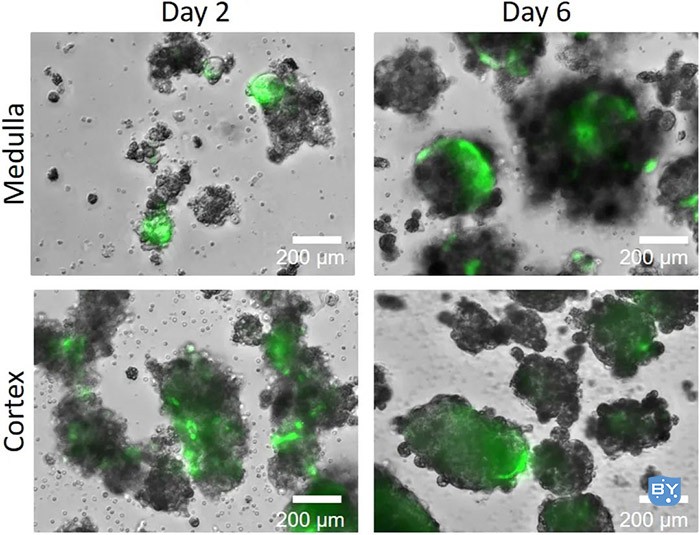
图6.增殖和球体形成
在24孔低附着板中接种解离细胞(来自10只小鼠)1-2天后,细胞开始聚集。3-4天后,创建球体。Nestin-GFP标记的细胞以绿色显示。
在此期间,可以添加不同的刺激。
五
细胞分化
如果要分化细胞,培养条件必须改变为依从性,并且必须从培养基中去掉bFGF。
1、在37°C的培养箱中用聚-D-赖氨酸16-24小时(300μL /孔,1mg / mL聚-D-赖氨酸在PBS中)涂覆24孔板或8孔室载玻片。
自选:对于成像,可用8孔腔室载玻片可提供最佳结果。否则,(用于收集培养基和/或RNA)正常的24孔板可用于分化。
2、用PBS仔细清洗孔3次。
3、加入纤连蛋白(300μL /孔,0.6nM在PBS中)并在培养箱中在37°C下孵育3小时。
4、用PBS小心清洗3次
5、将球体转移到涂覆的8孔腔室载玻片上:
a、使用 1000 μL 移液器小心地将球体转移到 1.5 mL 试管中。
b、在270×g下离心5分钟。
c、加入1 mL不含bFGF的新培养基。
d、将球体分布到所有腔室中,并用培养基(300μL /孔)填充
6、3-4小时后,细胞附着并开始分化。
7、应每周更换 2 次培养基,方法是移除旧培养基并添加新培养基。然后细胞可以培养至少28天。
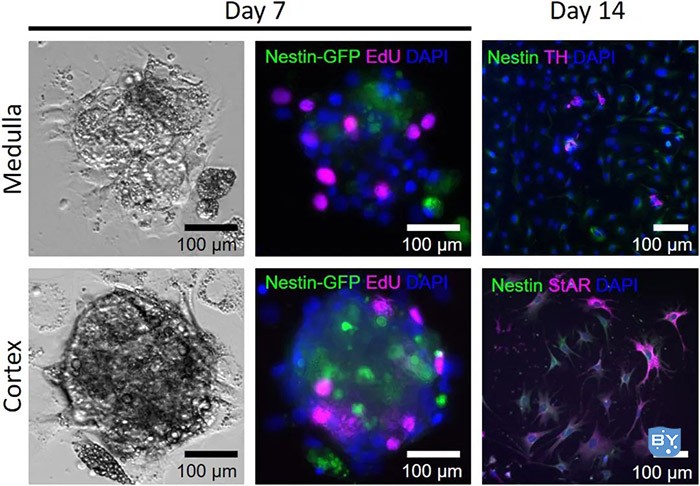
图 7.肾上腺细胞分化
在增殖至少6天后,细胞被转移到依从性条件下,在那里它们将开始分化。转移后3小时,细胞开始粘附,可以通过EdU染色鉴定增殖细胞。分化7天后(第14天),细胞已从球状体中扩散。此外,大多数细胞已经失去了Nestin的表达,并且对分化标志物如StAR(皮质)和酪氨酸羟化酶(髓质)呈阳性。
 文章推荐
文章推荐