
细胞免疫疗法是目前治疗癌症和传染病最先进的疗法之一,尤其是嵌合抗原受体 T(Chimeric antigen receptor-modified T,CAR T)细胞疗法的占比更是实现了前所未有的增长。经基因工程改造靶向肿瘤抗原的重组 T 细胞获得了举世瞩目的治疗效果,特别是在治疗血液系统恶性肿瘤方面取得了可喜的成果。美国食品和药物管理局(Food and Drug Administration,FDA)已批准了两种靶向 CD19 的 CAR T 细胞产品 Yescarta 和 Kymriah 用于治疗淋巴母细胞白血病和 B 细胞恶性肿瘤。
临床上将患者体内的T细胞分离出来后,在体外运用基因工程的方法使其表达CAR,赋予这些T细胞识别肿瘤细胞的能力,并在体外扩大培养至治疗所需剂量后,再将CAR T细胞回输到病人体内,定向杀伤肿瘤。
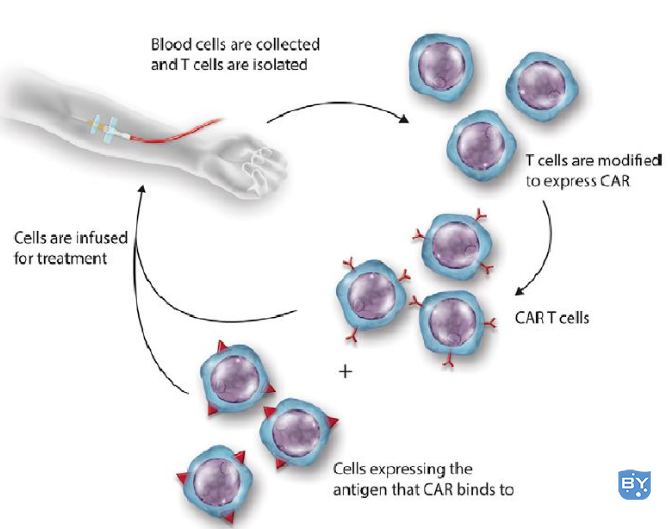
CAR T细胞治疗流程
今天结束的就是CAR T细胞治疗研究中的重要实验方法,即CAR T细胞活化水平以及增殖能力的检测。
CAR T 细胞活化水平的检测
细胞激活指标 CD69、细胞脱颗粒指标 CD107a、细胞杀伤因子指标如干扰素-γ、颗粒酶 B 均可以指示 CAR T 细胞的活化水平,并且这些指标可通过细胞表面染色或细胞内染色后使用流式细胞术进行检测。
(1)细胞表面染色
① 先将靶细胞消化后,与 CAR T 细胞分别计数,调整细胞密度至 2×106个/mL,在共孵育的超低吸附 96 孔板的孔中加入 15 μL肿瘤细胞,按效靶比(E:T)3:1分别加入 NT、NKG2D-CAR T、IL-4R/IL-15R-NKG2D-CAR T 细胞,再加入 X-VIVO 基础培养基补齐至 200 μL,吹打混匀后,37℃,5%CO2培养。
② 收集每个孔中的细胞悬液,加入 1 mL FACS 洗液,混匀后,1200 rpm 离心 3 min,弃上清,重复洗涤一次。每个样品中加入 100 μL FACS 洗液和对应的抗体,4℃避光染色 30 min 后,加入 1 mL FACS 洗液,混匀,1200 rpm 离心 3 min,吸去上清,再加入 1 mL FACS 洗液,重悬细胞后,1200 rpm 离心 3 min,吸去上清。加入 300 μL FACS 洗液重悬细胞并过滤后,进行流式检测。
(2)细胞内染色
① 前期处理过程同上一步骤①。
② 每个共培养体系中加入蛋白转运剂Golgiplug(10 μg/mL),吹打混匀后,继续培养4~6 h。
③ 分别收集细胞悬液,加入1 mL FACS洗液,混匀后,4℃,1200 rpm离心3 min,弃上清,重复洗涤一次。若需要同时检测细胞表面分子,则先进行细胞表面染色,步骤同步骤②。洗去抗体后加入200 μL细胞破膜固定液,重悬后4℃避光孵育20 min。若无需检测细胞表面分子,则直接加入200 μL细胞破膜固定液,重悬后4℃避光孵育20 min。
④ 加入1 mL 1×washing buffer,混匀,4℃,1200 rpm离心3 min,弃上清,重复洗涤一遍。进行胞内染色,每个样品中加入100 μL 1×washing buffer和对应的抗体,混匀后4℃避光染色30 min。加入1 mL FACS洗液,4℃,1200 rpm离心3 min,弃上清,重复洗涤一遍,加入300 μL FACS洗液重悬细胞并过滤后,进行流式检测。
CAR T 细胞增殖能力的检测
(1)计数检测 T 细胞数目变化
对 NKG2D-CAR T、IL-4R/IL-15R-NKG2D-CAR T 细胞进行计数,将细胞密度调整为 3.3×105个/mL,每种细胞取六份,每份为 100 μL 即 3.3×104个,加入 48 孔板中,三份中分别加入 2×105个 Panc-1 细胞,所有孔补齐至 300 μL,37℃,5% CO2培养。第 2 天和第 4 天分别计数 T 细胞数目,并记录数据,分析细胞绝对数量的扩增情况。
(2)eFlour670 染色检测 T 细胞增殖
对 Mock T、NKG2D-CAR T、IL-4R/IL-15R-NKG2D-CAR T 细胞计数后,各取 4×106个细胞,1200 rpm 离心 3 min,弃上清,加入 1 mL PBS 洗涤三次后,加入 500 μL PBS 和 0.5 μL eFlour670 染料(终浓度为 5 μM/mL),重悬细胞后 37℃避光孵育 15 min。再加入 4 mL 预冷的 DMEM 完全培养基,混匀后 4℃静置 10min,终止染色反应。1200 rpm 离心 3 min,弃上清,加入 3 mL PBS 重悬细胞后,1200 rpm 离心 3 min,弃上清,重复洗涤 2 次后,加入 X-VIVO 基础培养基重悬细胞沉淀,计数并调整细胞密度至 2×106个/mL,每种细胞取六份,每份中分别取 250 μL 即 5×105个,加入 24 孔板中,三份中分别加入 5×105个 Panc-1 细胞,所有孔加入 X-VIVO 基础培养基补齐至 500 μL 进行培养。 每 2 天取少量相同体积的细胞悬液,加入 FACS 洗液补至 300μL 左右,过滤后上流式进行检测。
 文章推荐
文章推荐