
自噬发生时,细胞内会形成一种称为吞噬泡的小囊泡样结构,首先与需降解的胞质成分集结在一起,然后隔离膜延伸并包裹封闭胞浆成分形成一个双层膜的结构即自噬体(autophosome),自噬体与溶酶体融合形成自噬溶酶体(autopholysome),其中包裹的胞质成分最终在溶酶体酶的作用下被降解利用。
目前,自噬的检测方法可分为两种∶直接法和间接法。
直接法指直接观察自噬体的形态,例如通过透射电子显微镜观察自噬性结构的形成是检测自噬现象较直接和较经典的方法(图1)。
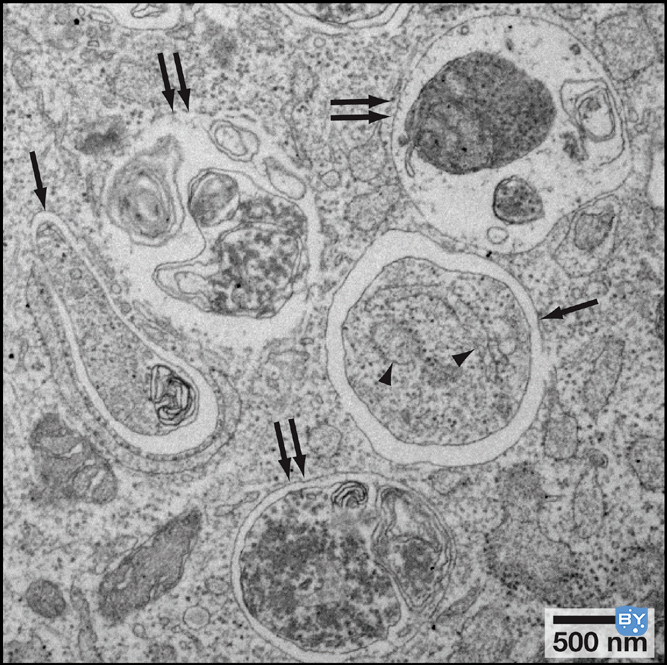
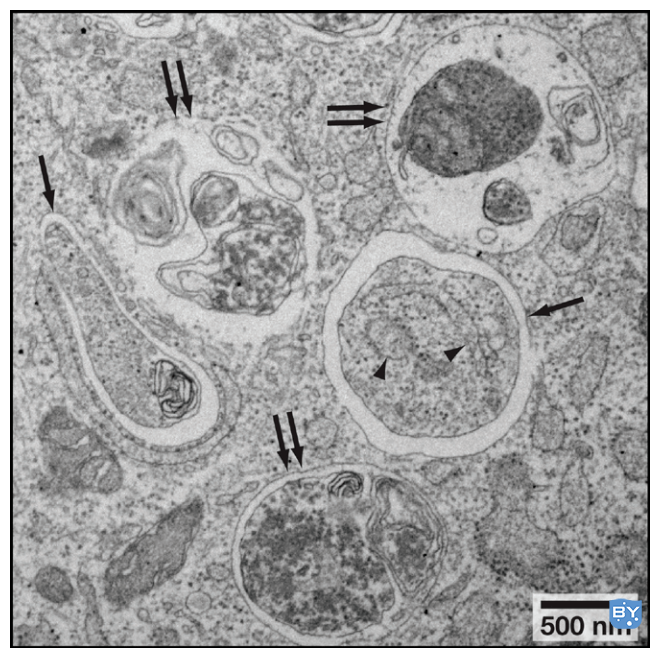
图1、透射电镜下自噬小体(单箭头)和自噬溶酶体(双箭头)形态
(Noboru, Mizushima et al. Cell, 2010)
间接法通常指通过免疫组织化学、免疫荧光及Westem blot等方法对自噬体表面蛋白标记分子进行检测。
LC3为微管相关蛋白1轻链3(microtubule-associated protein1 light chain 3,LC3/Atg8),是自噬体膜上的标记蛋白分子。细胞内存在两种形式的LC3蛋白∶LC3-Ⅰ和LC3-Ⅱ。LC3蛋白合成后其C端被Atg4蛋白酶切割变成LC3-Ⅰ,LC3-I分布于细胞质内,当自噬体形成后,LC3-I和磷脂酰乙醇胺耦联形成LC3-Ⅱ并定位于自噬体内膜和外膜上。与其他定位于自噬性结构膜上的Atg蛋白不同(仅在自噬过程的某一阶段发挥作用),LC3-Ⅱ始终稳定地保留在自噬体膜上,直到与溶酶体融合,因此常被用来作为自噬体的标记分子。
1) GFP-LC3单荧光和mCherry-GFP-LC3双荧光指示系统
自噬形成时,GFP-LC3或mCherry-GFP-LC3融合蛋白转移至自噬体膜,在荧光显微镜下形成多个明亮的绿色或黄色荧光斑点。当自噬溶酶体形成后,酸性的溶酶体环境使GFP荧光淬灭,而mCherry荧光不受影响,自噬溶酶体呈现红色荧光(图2)。因此,科研工作者可以通过LC3荧光指示系统来监测自噬流。
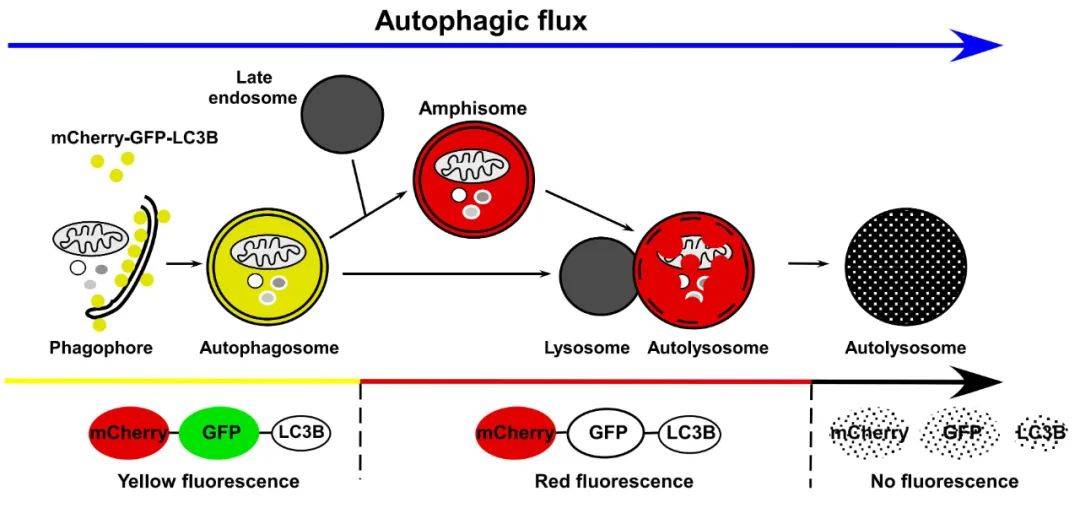
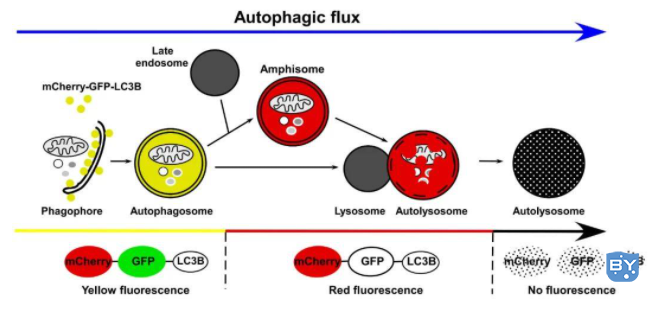
图2、 LC3自噬双标系统追踪自噬流不同阶段
(Hansen T E, Johansen T. BMC Biology, 2011)
2) Western Blot检测LC3和p62蛋白的表达量
① 利用Western Blot检测LC3-II/I比值的变化以评价自噬形成(如图3)。自噬形成时,胞浆型LC3-I会酶解掉一小段多肽,随后跟PE结合转变为膜型的LC3-II。因此可以通过LC3-II/I比值的大小估计自噬水平的高低。
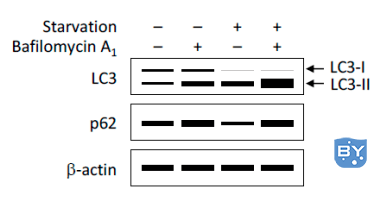
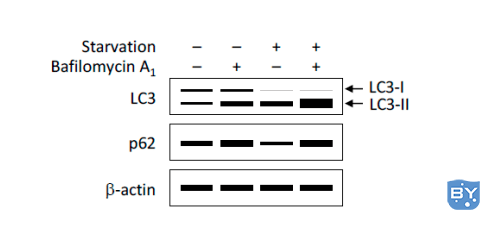
图3、WB检测LC3、p62蛋白的表达
(Yoshii, S.R. and N. Mizushima. Int J Mol Sci, 2017.)
② 除LC3外,其他自噬底物表达量的变化也可以用于监测自噬流。其中,p62是研究广泛的一个自噬底物。p62(也称为SQSTM1蛋白),由以下三个结构域组成:N端Phox和Bem1 (PB1)结构域、锌指结构域和C端泛素相关(UBA)结构域。研究表明,p62蛋白锌指结构域和UBA结构域之间的连接区域(LRS区域)负责与自噬受体蛋白 Atg8/LC3结合,UBA结构域负责招募泛素化蛋白。在自噬体形成过程中,p62作为链接LC3和聚泛素化蛋白之间的桥梁,被选择性地包裹进自噬体,之后被自噬溶酶体中的蛋白水解酶将其降解(图4),所以p62蛋白的表达量与自噬活性呈现负相关。因此,利用Western Blot检测p62蛋白的表达量也可以用来评价自噬水平(图3)。
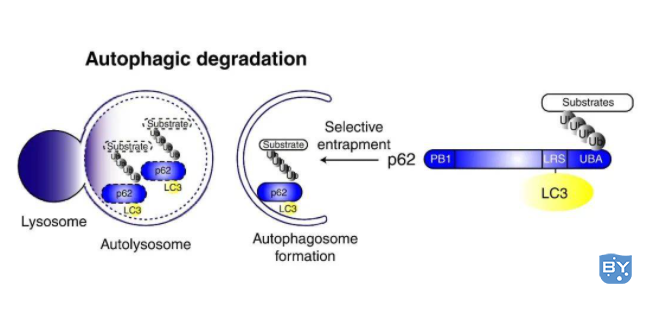
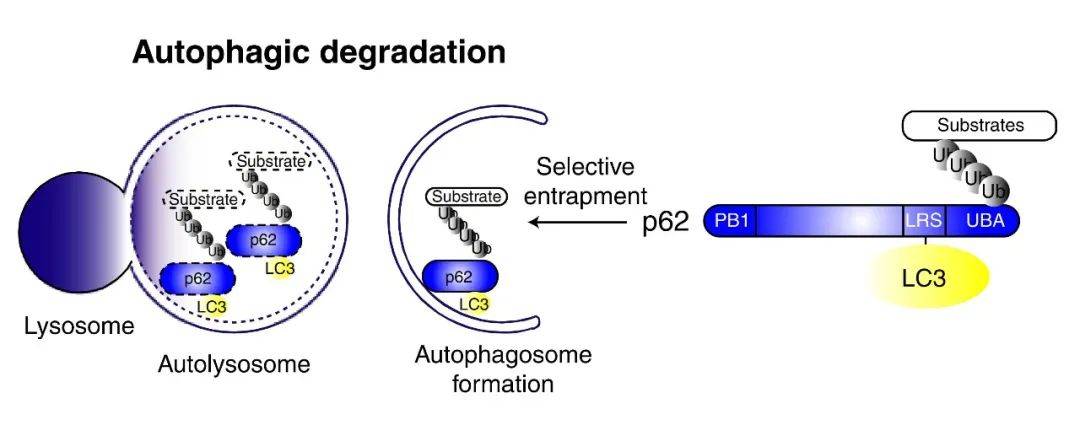
图4. p62介导的选择性自噬模型(Ichimura Y et al. J Biol Chem, 2008)
 文章推荐
文章推荐