
本文翻译自Bio-protocol。Bio-protocol是为一线科研人员服务的期刊,其专精于遴选、发表从基础到高级,从传统到创新的各种实验方案。
原理简介
Hu等在2002年最先报道了一种直观、快速地判断目标蛋白在活细胞中的定位和相互作用的新技术——双分子荧光互补(Bimolecular fluorescence complementation,简称BiFC)。该技术巧妙地将荧光蛋白分割成两个不具有荧光活性的分子片段(N-fragment、C-fragment),将这两个荧光蛋白的片段分别融合两个目标蛋白A、B,如果A与B蛋白发生了相互作用,在空间上互相靠近,就会重新构建成完整的具有活性的荧光蛋白分子,在激发光的激发下,荧光蛋白发出荧光。反之,若A与B蛋白之间没有相互作用,则不能被激发出荧光。
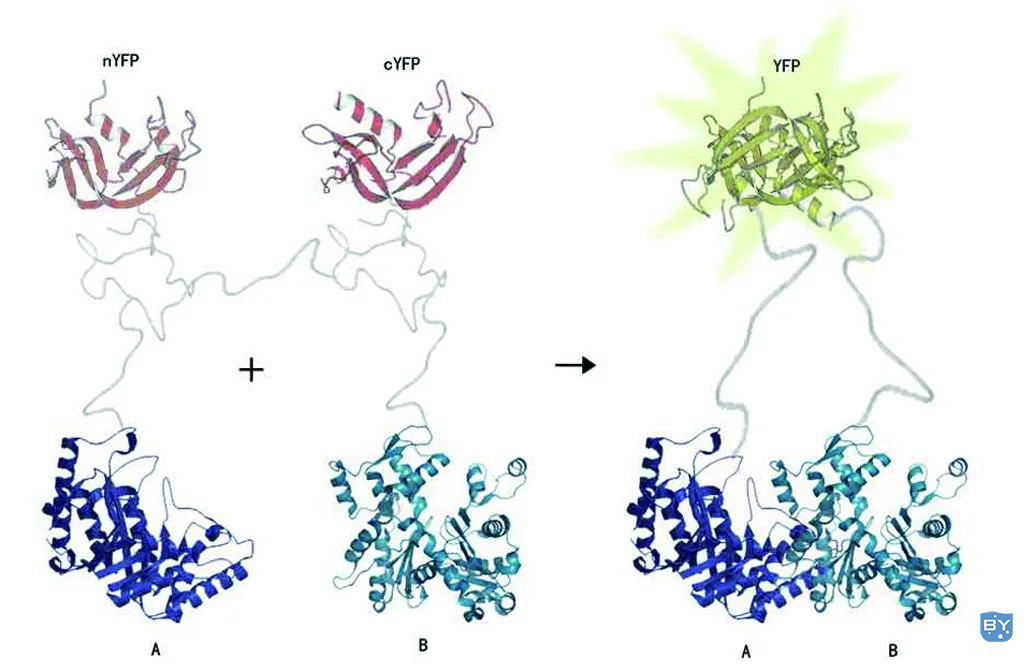
图1 双分子荧光互补实验原理。
摘要
用消化酶酶解植物的细胞壁后,得到的原生质体仍具有良好的细胞活性,可用于聚乙二醇(PEG)介导的瞬时转化实验,使靶基因能够在活的植物细胞中表达。本方案的目的是利用水稻原生质体和绿色荧光蛋白(GFP)作为实验系统通过共聚焦显微镜来观察体内蛋白质的相互作用。其中,共聚焦显微镜采用505~530nm发射滤光片,来消除植物细胞自发荧光的干扰。
材料和试剂
1. 水稻种子(Oryza sativa L.)
2. 甘露醇(Sigma-Aldrich)
3. 吗啉乙烷磺酸(MES)(Sigma-Aldrich)
4. 纤维素R-10(Yakult Honsha)
5. Macerozyme R-10(Yakult Honsha)
6. 牛血清白蛋白(BSA)(Sigma-Aldrich)
7. 羧苄青霉素/氨苄西林(AMRESCO)
8. β-巯基乙醇(β-ME)(Amresco)
9. 聚乙二醇4000(PEG)(Sigma-Aldrich)
10. 酶溶液(见配方)
11. PEG4000溶液(见配方)
12. W5溶液(见配方)
13. MMG溶液(见配方)
仪器设备
1. Shaker P270(中国科学院武汉科学仪器厂)
2. 涂有胶原蛋白的35mm直径玻璃盘
3. Vortex XW-80A(嘉鹏科技)
4. 尼龙网(35μm)(EMD Millipore)
5. 真空泵
6. 50mL圆底离心管
7. 2mL离心管
8. 台式离心机(Eppendorf 5810R和5417R)
9. 共聚焦显微镜(Olympus,型号:FV1000)
10. OLYMPUS FV1000系统(Fluoview Ver.1.7b Viewer)(Olympus)
实验步骤
1.原生质体制备
(1)将100粒消毒过的水稻种子放在湿纱布上,在28°C的黑暗条件下萌发约1周。
(2)当黄化苗长到约7~8cm时,收集黄化苗,用锋利的刀片将幼苗切成0.5mm左右的小段,然后将这些小段充分浸入50mL 0.6M的甘露醇溶液中10min。
(3)将幼苗小段转移到酶溶液中。
(4)使用真空泵去除组织中的空气,使它们在酶溶液中完全沉淀。
(5)将浸有组织的溶液保持在28°C的黑暗中,并在振动筛上以80rpm的速度震荡约4h。
(6)用ddH2O清洗尼龙网(35μm),然后用W5溶液润湿3~5min,用于过滤原生质体,将酶消化的样品过滤到50mL圆底离心管中。稍微转动尼龙网以提高过滤量。
(7)以100×g离心过滤5min,弃去上清液并用移液管尽可能多地去除残留液体,然后加入10mL预冷的W5溶液,轻轻旋转重悬原生质体。
(8)将试管在冰上孵育30min(以下操作均在室温下进行)。
(9)以100×g离心5min沉淀原生质体,弃去上清液并尽可能多地去除残留液体,然后轻轻加入1mL MMG溶液重悬原生质体。最后,在显微镜(40×)下将原生质体密度调整为2x105 cells/mL。
2.原生质体转化
注意:在原生质体转化之前,请根据Walter等人(2004)的protocols准备BiFC表达载体。我们建议参考Sheen实验室网站上有关如何使用CsCl梯度制备质粒DNA的信息(
http://genetics.mgh.harvard.edu/sheenweb/protocols.html)。
(1)将100μL原生质体分装到2mL离心管中。
(2)空载体pUC-SPYNE/pUC-SPYCE和bZIP6-YFPN/bZIP6-YFPC分别用作阴性和阳性对照。将20μL BiFC载体(≥1-2μg/μL,每个载体10μL)、阴性对照和阳性对照分别加入管中,然后轻轻混匀。
(3)向每个管中加入等体积(120μL)PEG溶液并混合均匀。
(4)将混合物孵育15min之后进行转化。
(5)添加480μL W5溶液以停止转化。
(6)将溶液以100×g离心2min,并弃去上清液。
(7)加入1mL W5溶液轻轻重悬原生质体沉淀。在将原生质体转移到培养板之前,加入1μL羧苄青霉素(50mg/mL),在室温下黑暗培养16~20h以允许BiFC蛋白表达。
(8)在共聚焦观察之前,转化的原生质体应以100×g离心2min,去除大部分上清液,然后重悬原生质体。
3.共聚焦观察
(1)将原生质体转移到涂有胶原蛋白的35mm直径玻璃盘中进行显微观察。
(2)共聚焦荧光信号的收集在Olympus FV1000系统上进行。
(3)实验中自发荧光问题的干扰可以通过共聚焦显微镜中的光学滤光片来消除。我们选择使用488nm氩激光线和505~530nm带通发射滤波器激发。
(4)在这种观察方式下,阳性对照呈强黄色荧光,阴性对照呈黑色。这证实了上述所有操作对于BiFC观察都是可靠的。
溶液配方
1.酶溶液(10mL)
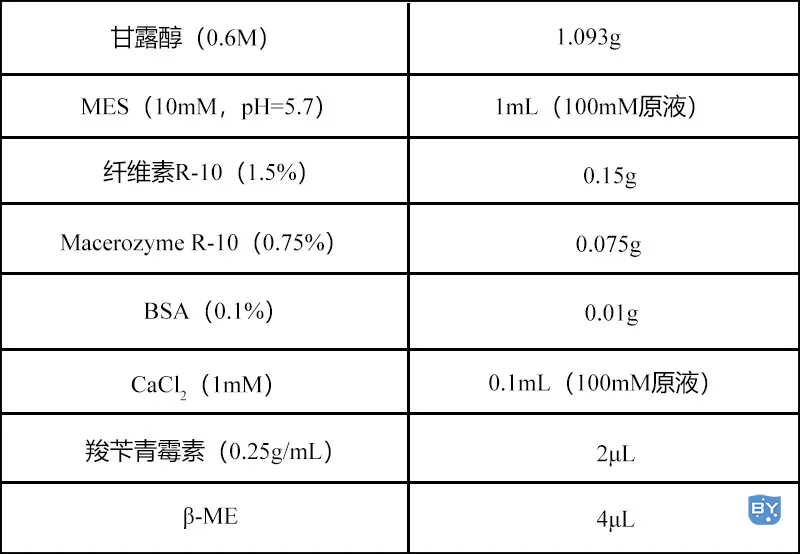
加入ddH2O至10mL,55°C 10min自然冷却(现配现用)
2.PEG4000溶液

添加ddH2O至10mL,使用1M KOH将pH值调节至7.5~8.0,用1.5mL离心管分装并保存在-20°C。
3.W5溶液
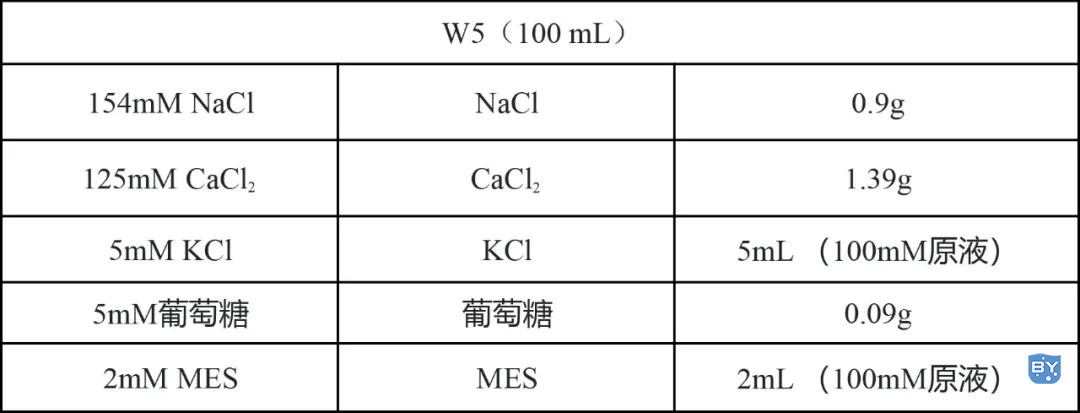
用KOH调pH至5.8,高温高压灭菌20min,室温保存
4.MMG溶液

用KOH调pH至5.8,高温高压灭菌20min,室温保存
References:
Wymer, C. L., Beven, A. F., Boudonck, K. and Lloyd, C. W. Confocal microscopy of plant cells. Methods Mol Biol, 1999, 122: 103-130.
Whang, S. S. Confocal microscopy study of Arabidopsis embryogenesis using GFP: mTn. J Plant Biol, 2009, 52(4): 312-318.
Walter, M., Chaban, C., Schutze, K., Batistic, O., Weckermann, K., Nake, C., Blazevic, D., Grefen, C., Schumacher, K., Oecking, C., Harter, K. and Kudla, J. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant J, 2004, 40(3): 428-438.
Yoo, S. D., Cho, Y. H. and Sheen, J. Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis. Nat Protoc, 2007, 2(7): 1565-1572.
 文章推荐
文章推荐