
细胞内蛋白质之间的相互作用或形成蛋白复合物在细胞的生命活动过程中起着重要的作用,目前有多种手段能够实现蛋白质相互作用的研究,如免疫共沉淀、GST pull down、表面等离子共振、酵母双杂交等。本文主要对一种近年来发展起来的蛋白质相互作用研究方法—双分子荧光互补(bimolecular fluorescence complementation,BiFC)技术做一介绍。
实验原理
双分子荧光互补(Bimolecular fluorescence complementation, BiFC),该技术是利用荧光蛋白的特点来研究蛋白的相互作用。荧光蛋白可从特定的位点被分开,产生两个非荧光活性片段。当两片段分别被融合到相互作用的蛋白上时,会因蛋白的相互作用力而被拉近、发生互补从而重新构建成有活性的荧光蛋白并在激发光下产生荧光。因此利用荧光显微镜就可以直接通过观察荧光有无来判断蛋白是否发生相互作用。
其工作原理如图1所示。
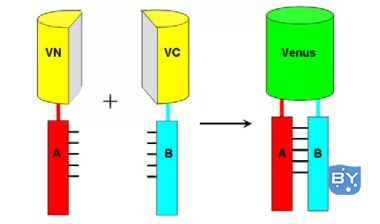
图1 双分子荧光互补原理示意图(He et al., 2012)
荧光蛋白交叉系统
目前可以用于BiFC技术的荧光蛋白有YFP,GFP,BFP、CFP、Venus和mRFP等,本次介绍YFP和Venus荧光蛋白交叉的系统,即YN155 (YFP的第1-155位氨基酸,其中第YFP的第65位氨基酸由F突变为L,该点突变促进荧光蛋白的成熟)和VC156 (Venus的第156-239位氨基酸)配合使用的系统。该系统降低了假阳性和假阴性线性现象。
载体信息
该系统包含两个载体,即pIB-YN155 (载体示意图,如图2所示)和pIB-VC156 (载体示意图,如图3所示),均由pIB-V5/His载体(载体示意图,如图4所示)改造而来。
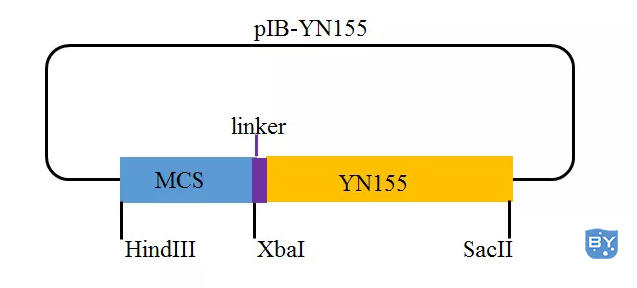
图2 pIB-YN155载体示意图
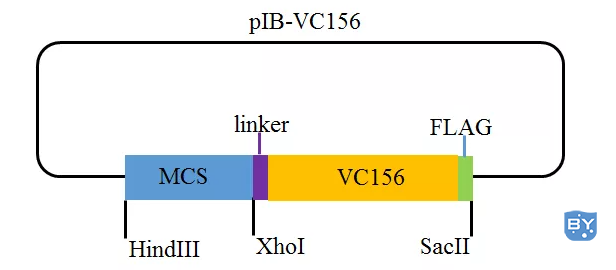
图3 pIB-VC156载体示意图
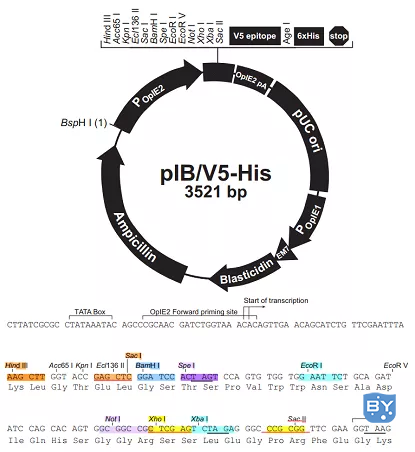
图4 pIB-V5/His载体示意图
重组载体的构建
仅需要将待筛选的基因克隆到pIB-YN155和pIB-VC156载体上即可。严格意义上,每个基因需要同时构建到上述两个载体上。但是若只构建到一个载体上,就足以检测到互补荧光的产生,则可以不用构建到另一个载体上。
克隆载体时候,要注意使用的酶切位点,确保插入的目基因与后面的YN155或者VC156的ORF对框,确保融合蛋白的正确翻译。
共转染至同一细胞内,用荧光显微镜观察荧光互补结果。
注意:本实验需要设置阴性对照。即用pIB-YN155和pIB-nVC156 (VC156的N端带有atg,可以单独表VC156蛋白)。利用荧光显微镜观察时,需要调节荧光强度,在阴性对照组无荧光信号的情况下,观察实验组的荧光信号。
BiFC优缺点
BiFC优点:
灵活:既能够用于体内相互作用的研究,也能够用于体外相互作用的研究;
快速直观:能够在显微镜下直接观察到相互作用结果;
适用性广:BiFC系统已经被成功应用于动物,植物,真菌和细菌等不同的宿主细胞中;
背景干净,灵敏度高:验证结果只需检测荧光的有无,背景干净,灵敏度高;
能够检测弱相互作用及瞬时相互作用;
对仪器要求低,成本可控,数据处理相对简单;
BiFC缺点
对温度敏感:温度高时片段间不易互补形成完整的荧光蛋白,这会对研究细胞在生理条件下的相互作用带来负面影响(目前,只有基于venus、citrine和cerulean的BiFC系统可以在生理温度条件下实现片段互补);
信息滞后,无法随时观察:BiFC系统想要检测到荧光,需要经过两个荧光蛋白片段互补重新形成完整的活性蛋白,以及荧光蛋白自体催化两个过程,该过程往往需要几分钟到几小时,因此观察荧光信号滞后于蛋白质的相互作用过程,不能实时地观察相互作用过程;
 文章推荐
文章推荐