
通过流式细胞术鉴定细胞通常使用针对细胞表面特定靶标的荧光标记抗体来完成。研究人员通常根据这些目标命名细胞,通常称为分化簇或 CD。例如,T 细胞受体的成分之一是 CD3,因此研究人员通常会使用针对该靶标的抗体来识别该谱系并将其与其他不表达该蛋白质的细胞分开。
回到免疫学的基础,可以将抗体可视化为“Y”形蛋白质。主链由两条通过二硫键连接的重链组成。在 Y 叉的两侧是另外两个称为“轻链”的蛋白质,它们也通过二硫键与该主链结合。抗体的活性位点位于 Y 末端,特异性由重链和轻链共同决定。
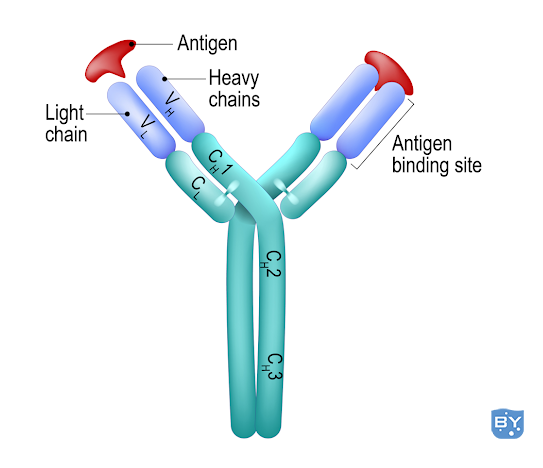
图 1 :抗体的结构。结合位点在左臂上圈出。
重链和轻链来自 DNA 中不同片段的组合。在重链可变区的情况下,这包括三个单元——变量、多样性和连接部分。轻链只有两个单元,可变部分和连接部分。然后将它们连接到恒定片段以形成完整的肽。这就是导致体内大量抗体的原因。
然而,这仅仅是开始,精炼这些抗体的过程涉及体细胞超突变,这会在可变域中诱导点突变,从而影响抗体的特异性和亲和力。
抗体类别转换
更复杂的是,这些抗体可以经历一个称为类别转换的过程。首次制备抗体时,未成熟 B 细胞会表达 IgM 形式的抗体。随着细胞成熟成为幼稚 B 细胞,它会同时表达测试抗体的 IgM 和 IgD 形式。这些作为早期预警系统,随时准备对新抗原作出反应。
研究中的抗体
我们将这些不同的形式称为“同种型”,每一类同种型在体内都有不同的生物学特性。人类重链有五种不同的重链类别,而轻链有两种。
用于研究的抗体可以是多克隆抗体也可以是单克隆抗体。
多克隆抗体通常通过将免疫原注射到动物体内并收集血清来制备。这导致抗体库可以与免疫原的不同部分(表位)结合,从而增加对抗原的亲和力。然而,这也导致与非目标更高的非特异性结合。
单克隆抗体是通过将单个 B 细胞与永生化细胞融合形成杂交瘤来制备的,该杂交瘤产生具有单一特异性的抗体。可以筛选这些杂交瘤,并且只保留那些对产生大量蛋白质的靶标具有高亲和力的杂交瘤。
在流式细胞术中,由于单特异性、生产的一致性等,单克隆抗体是优选的。然而,人们总是担心这些抗体可能与靶细胞发生非特异性结合。
输入同型对照。同种型对照背后的想法是,它是一种与实验抗体具有相同同种型的抗体,但针对目标细胞上不存在的物质产生。例如,克隆 UCHT1,(小鼠抗人 CD3)具有 IgG1,κ 同种型。如果担心这种抗体与目标细胞的非特异性结合,可以用同种型对照(例如 MOPC-21)标记不同的试管,它也是 IgG1、κ 的同种型。该抗体由小鼠骨髓瘤制成,特异性未知。因此理论认为,如果 MOPC-21 与细胞结合,研究人员会将阳性门设置在同位素对照的染色水平之上,如下图 2 所示。
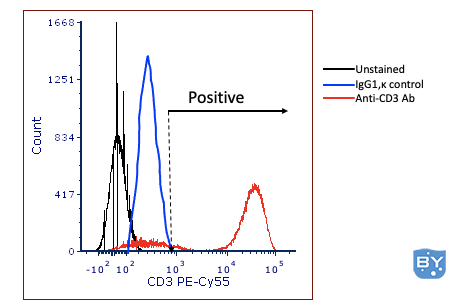
图 2 :使用同型对照设置“阳性”。
在使用同型对照设置阳性时需要考虑一些假设和注意事项,同型对照的有用性在很大程度上取决于它违反这些假设的程度。
同种型对照对脱靶的亲和力与对目标抗体的亲和力相同。由于使用同型对照的目的是通过识别背景非特异性染色来确定阳性,因此该特征在两种试剂上必须相同是很重要的。这不是文献中测量或报告的东西,因此,这个假设很容易被违反,降低了同种型控制的有效性,以帮助确定阳性。
对感兴趣的细胞没有同种型控制的目标。以 MOPC-21 为例,它是在喂食矿物油的小鼠骨髓瘤中制成的。典型的供应商文献表明,抗体是在对一组不同物种的组织进行筛选后选择的。可以问一个问题:筛选的详细程度如何?
荧光染料与蛋白质 (F/P) 的比率相同。这是对有多少荧光染料与感兴趣的蛋白质结合的量度。在大荧光染料(如 PE)的情况下,存在空间限制,使得 F/P 比约为 1:1。然而,对于荧光素等较小的分子,不同的蛋白质可能具有截然不同的 F/P 比。这样做的结果是,如果同种型对照的 F/P 比高于感兴趣的抗体,非特异性结合会由于更高的 F/P 比而更亮,从而导致研究人员误入歧途。
总之,违反这三个假设中的任何一个都会将同种型控制更改为另一个实验变量,从而消除其价值。事实上,早在 1999 年,临床研究人员就质疑在分析中使用同型对照。1
最近,Andersen 及其同事的一篇文章回顾了这个问题以及阻断 Fc 介导的与其靶细胞结合的方法。2他们得出的结论是,适当的封闭比使用同种型对照更重要,由于研究人员从商业上获得的同位素对照的质量存在差异,这一点得到了很好的证明。
总之,应该注意的是,在流式细胞术中使用同种型对照还没有达成共识。重要的是不要过度解释同型对照,即不要使用它来设置阳性。然而,它有助于显示细胞的阻断很差或不完整,并且当以这种方式使用时,确实为研究人员提供了一些信息。然而,由于上述限制,大多数流式细胞仪已不再在实验中使用这些试剂。
资料来源:
基尼等人。(1998)流式细胞仪分析淋巴细胞和 CD34+ 干细胞和祖细胞的同种型对照——是时候放手了!细胞术 34:280-283 PMID: 9879645
安徒生等人。(2016)消除由抗体与人单核细胞和巨噬细胞上的 Fc 受体结合引起的流式细胞术错误结果。细胞术 A:89A:1001-1009。DOI: 10.1002/cyto.a.22995
 文章推荐
文章推荐