
抗体可以以特定方式与细胞结合——抗体的 FAB 部分与高亲和力的特异性靶标结合,或者抗体的 FC 部分与某些细胞表面的 FcR 结合。
它们还可以以非特异性方式与细胞结合,其中 FAB 部分与低亲和力、非特异性靶标结合。此外,随着细胞死亡和膜完整性受损,抗体可以非特异性结合细胞内靶标。
问题一直是如何识别和控制观察到的非特异性抗体结合。
这导致许多研究小组使用称为同型对照的对照。
这种对照的概念是靶向不在靶细胞表面上的蛋白质的抗体,具有与感兴趣的抗体相同的同种型(重链和轻链)。当用于标记细胞时,那些显示与同种型结合的细胞将被排除,因为它们代表细胞的非特异性结合。
当同型对照就是一切
同种型对照曾经是流式细胞术实验的阴性对照。
它们仍然经常被一些实验室包含,几乎被其他实验室所抛弃,并且是许多初学者困惑的主题。它们是什么,为什么以及何时需要它们?它们有任何用处,还是只是浪费钱?
最重要的是,为什么审稿人在审阅包含流数据的论文时总是要求他们?
同型对照通常用于显示您在实验中可能具有的非特异性结合水平。这个想法是,抗体可能以多种方式与细胞表面发生不良反应。
并非所有这些都可以通过这种控制直接解决(例如与不同抗原上相似表位的交叉反应,甚至与同一抗原上不同表位的交叉反应)。它所做的是为您提供非特异性(非表位驱动)结合的估计。这可以是 Fc 介导的结合,或完全非特异性的“粘性”细胞粘附。
为了有用,理想情况下,同种型对照应该是相同的同种型,在物种、重链(IgA、IgG、IgD、IgE 或 IgM)和轻链(κ 或 λ)类别方面,相同的荧光染料( PE、APC 等),并具有相同的 F:P 比。F:P 衡量每个抗体上存在多少荧光分子。
不幸的是,这使得理想同种型对照的制造非常不切实际。
甚至有一种情况是,轻链和重链可变区的氨基酸序列的差异可能会导致同种型与您的目标抗体的不同程度的不良粘附。
超越同型对照
由于这些原因,该领域的许多人正在超越同种型控制。有些人建议他们被排除在几乎所有实验之外。
如果您花时间浏览 Purdue Cytometry 列表,您会在关于同型对照的线程中看到这些相同的论点。
以下文件介绍了多个类别的控件选项、可用选项以及每个选项的优缺点。关于同型对照的部分非常清楚地总结了使用同型对照的问题……
流式细胞仪控制、仪器设置和阳性测定。
此外,以下文件介绍了多个类别的控件选项、可用选项以及每个选项的优缺点……
临床流式细胞术中背景荧光控制的考虑。
上述论文中侧重于同型对照的部分非常清楚地总结了它们的使用问题。
该文章还说明了使用来自不同制造商的相同克隆在不同水平上的不良结合差异。
请参阅下图,了解即使是相同的同种型对照克隆如何导致高度可变的不良染色水平。
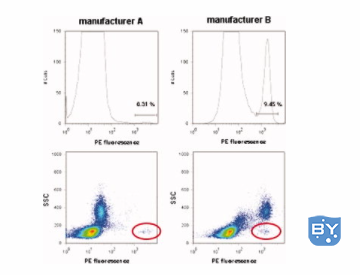
如果您在实验中使用同种型对照,它们必须尽可能多地匹配您的特定抗体的以下特征——种类、同种型、荧光染料、F:P 比和浓度。
使用(或不使用)同型对照的 9 个技巧
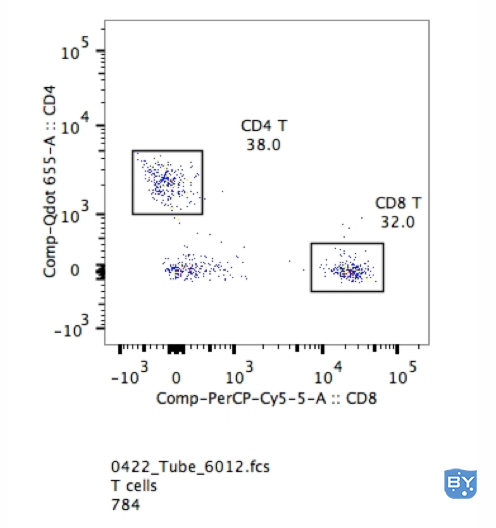
1. 对于明显双峰的事情,你当然不需要它们。如果您正在寻找外周血中的 T 细胞和 B 细胞,循环中的阴性细胞也可以提供门控信心。如下例所示,在裂解的小鼠血液样本中很容易挑出 CD4 和 CD8 阳性细胞。
2. 如果您使用的是培养后的细胞,同型对照可能会为您提供有关细胞固有“粘性”的一些信息。但是,这并不意味着您可以从特定抗体样本中减去荧光强度或阳性百分比的值。这只是对“粘性”和协议中阻塞有效性的定性衡量。
3. 如果您在搜索中使用多种染料,并且您担心光谱重叠的阳性,那么使用荧光减一对照 (FMO) 会更好,其中包含除您怀疑的抗体之外的所有抗体最容易因光谱重叠而出错。
4. 您绝对不应使用它们来确定阳性细胞与阴性细胞,或在您的测定中用作门控。
5. 请记住,避免对抗原阴性群体进行高水平背景染色的最佳方法是仔细滴定您的试剂,以确保在明亮群体中获得最高的阳性信号,同时减少在阴性群体中的扩散。
6. 如果您正在使用同型对照并且您看到高水平的非预期染色,那么是时候仔细查看您的方案中的封闭步骤了。如果您有骨髓细胞,您是否使用 Fc 阻滞剂?您是否尝试在缓冲液中添加过量的免疫球蛋白或全血清?这些中的每一个都可以帮助降低您的非特异性依从性。
7. 您确定您正在处理的是非特异性抗体粘附而不是游离荧光染料粘附吗?您可以通过使用等克隆控制来找出答案。如果您在染色反应中添加大量非荧光染料偶联单克隆抗体,您的荧光应该会下降。如果不是,您的问题不是由于非特异性抗体结合,而是由于游离荧光染料结合。
8. 对于细胞信号传导和细胞因子染色,除了 FMO 对照外,请确保不要忽略生物阴性对照,无论是未刺激的细胞,还是用磷酸化抑制剂处理的细胞。
9. 不要忘记在多色面板中使用活性染料。随着这些染料以不同颜色扩散并用于活细胞和固定细胞,没有理由不使用这些染料。活力染料对于去除非特异性吸收抗体的死细胞至关重要。
 文章推荐
文章推荐