
现有的细胞增殖和细胞毒性检测相关的实验方法种类繁多,准确性、经济性、可操作性不一,而且部分实验受限于实验室条件无法开展。选对适合的实验方法,不仅可以少走弯路、事半功倍、节省有限的经费和实验资源,而且有助于建立稳定精准的技术平台和进一步推进相关的研究。因此,本文对常见细胞增殖及细胞毒性检测的方法进行了汇总及比较。
一、细胞增殖
1.CCK⁃8法
将处于对数生长期的细胞以1×104个/孔接种于96孔板中,每个检测时间点设置5个复孔,每孔100μL培养体系。96孔板四周加入PBS以防止板中的细胞培养液蒸发。在37 ℃、5% CO2培养箱培养不同时间后,每孔分别加入10μL CCK-8试剂,以100μL细胞悬液+10μL CCK-8体系进行孵育。预实验确定最佳孵育时间,随后在培养箱中孵育一段时间后使用酶标仪在450 nm波长处测定吸光度值,OD(450 nm)实验组-OD(450 nm)空白对照的值间接反映活细胞的数量。空白对照指仅有培养液而未加细胞的孔。
2.EdU标记法
用培养基调整细胞密度为1×106个/mL进行EdU标记,预实验确定加入EdU的浓度为50μmol/L,培养箱孵育2 h。经4%多聚甲醛固定15 min和0.5% Triton X-100通透5 min处理后,每 1×106个细胞加入500μL现配的Click-iT反应混合物避光染色30 min后加入DAPI室温避光15 min进行核染色。使用流式细胞仪或者荧光显微镜检测与分析 EdU阳性的细胞占比。
3.CFSE标记法
将细胞用PBS洗涤1遍并重悬。2×106个/mL的细胞悬液加入1μL 5 mmol/L的 CFSE储存液,配制5μmol/L的工作液。37 ℃避光孵育10 min后,加入4℃预冷的5倍体积含血清的细胞培养液终止染色,5 min后离心,并用PBS洗2遍后,加入培养基继续培养。分别于CFSE 标记后的不同时间点用流式细胞仪检测细胞的平均荧光强度,扩增后与扩增前的平均荧光强度比值反映细胞的扩增倍数。
4.3种细胞增殖检测方法的比较

二、细胞毒性检测
1.Calcein-AM/CellTracker Deep Red活细胞染料双标流式法
用培养基将细胞调整为1×106个/mL,分别加入Calcein-AM 至终浓度2μmol/L、CellTracker Deep Red Dye至终浓度0.1 μmol/L,37℃避光孵育30 min后,PBS清洗2遍后用培养基将细胞密度调整为2×105个/mL,加入96孔U型底板,每孔加入100μL;向培养板各孔中加入不同浓度的毒性物质(药物、化学试剂等待检测物质),并定容至200μL。将培养板置于1 000 r/min离心1 min,放入37℃培养箱静置4 h进行杀伤后,吹匀细胞,用流式细胞仪上样,注意进样相同体积数的分组样品。双阳性细胞群为剩余活的细胞。设置阳性对照:标记过的细胞不加材料。细胞毒性(%)=(空白对照读数-实验组读数)/空白对照读数×100%。
2.荧光素酶法
将细胞的密度调整为1×105个/mL。然后铺96孔板,每孔加细胞悬液100μL,向培养板各孔中加入不同浓度的毒性物质(药物、化学试剂等待检测物质),空白对照不加材料,并定容至200μL。放置培养箱4 h后。按照每孔50μL用量,将2 mg/mL ATP溶液与300 ng/mL荧光素钠溶液按照1∶3配制发光底物混合液。取出孵育过后的96孔板,每孔加入50μL 2% Triton X-100,吹打混匀室温静置5 min,再次吹打混匀后每孔吸出50μL 转移到黑色96孔酶标板,并加入50μL发光底物混合液,吹打混匀后5 min内用活体成像仪或多功能读板机检测荧光值。细胞毒性(%)=(空白组荧光值-实验组荧光值)/空白组荧光值×100%。
3.LDH释放法
将细胞的密度调整为1×105个/mL,取100μL加入96孔培养板中,向培养板各孔中加入不同浓度的毒性物质(药物、化学试剂等待检测物质),定容至200μL;细胞自然释放孔加细胞和培养液各100μL,细胞最大释放孔加细胞和2.5% TritonX-100各100μL,放入培养箱中4 h。然后将96孔培养板以250 g离心5 min,每孔吸取上清100μL置于平底96孔培养板中,同时加入LDH基质液100μL,反应5 min,每孔加入30μL HCl(1 mol/L),在酶标仪490 nm处测定吸光度值。按下式计算细胞毒活性。细胞毒性(%)=[反应孔OD(490 nm)-自然释放孔OD(490 nm)/最大释放孔OD(490 nm)-自然释放孔OD(490 nm)]× 100%。
4.CKK-8检测法
制备细胞悬液,计数。在96孔板中接种细胞悬液,每孔约100μL,同样的样本可做3个重复。将培养板放入培养箱中预培养一段时间(37℃, 5%CO2),细胞贴壁需要大约2-4h,如果是悬浮细胞,该步骤可以省去。向培养板各孔中加入不同浓度的毒性物质(药物、化学试剂等待检测物质)。将培养板放入培养箱中孵育一段时间,例如6、12、24、48h,具体时间要看待测物质的性质和细胞的敏感性。向每孔中加入10μL CCK-8溶液,由于加入的CCK-8量比较少,可能会因试剂沾在孔壁上而带来误差,建议在加完试剂后轻轻晃动培养板以帮助混匀,或者直接配置含10% CCK-8的培养基,以换液的形式加入。另外注意,加样的过程中尽量不要产生气泡,以免影响OD值读数。将培养板放入培养箱中孵育1-4h。因为细胞种类不同,形成的formazan的量也不一样,所以如果显色不够的话,可以延长培养时间,特别是血液细胞形成的formazan很少,需要较长的显色时间(5-6h)。用酶标仪测定450nm处的吸光度(OD)。
细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)] ×100
A(加药):具有细胞、CCK-8溶液和药物溶液的孔的OD值
A(0加药):具有细胞、CCK-8溶液而没有药物溶液的孔的OD值
A(空白):没有细胞的孔的OD值
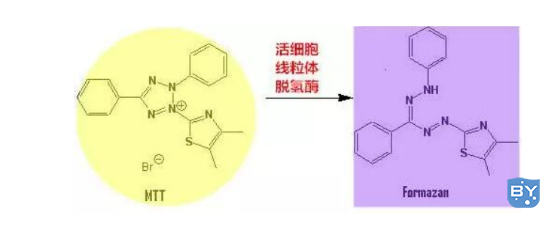
5.MTT检测法
(1)0.5%的胰酶消化对数期细胞,加少量血清终止反应,1000r/min,离心5min,吸去上清,将细胞沉淀用培养基吹打混匀,制成细胞悬液,细胞计数后调整其浓度至5-10×104个/ml,药物毒性实验一般每孔细胞数量5000—10000个(具体数目根据预实验判断)。
(2)将细胞悬液制备好后,轻轻混匀,每孔加入90μL细胞悬液, 这样待测细胞的密度为5000—10000/孔(边缘孔用无菌PBS填充)。
注意:因细胞在混匀后仍要继续沉降,因此接种的过程中要反复多次混匀,如每加5个孔就混匀一次,以确保接种的细胞密度在各孔之间完全相同,这对于MTT的结果至关重要。
(3)5%CO2,37℃培养箱继续培养,待细胞单层铺满孔底(96孔平底板),加入浓度梯度的药物。
(4)按照药物作用时间点,每24 h取出一块96孔板检测:
a) 每孔加入10 μL MTT溶液(5mg/ml),继续细胞培养箱培养4-6h;
b) 小心吸去孔内培养液(用移液器吸取孔内培养液,吸取的时候要注意移液头要紧贴孔内侧壁吸取,不要触碰底部的紫色结晶。或者将96孔板倒扣于滤纸上来吸取孔内的培养液);
c) 每孔加入150μL DMSO,置摇床上低速振荡10min,使结晶物充分溶解(加入 DMSO 溶解后,将加入DMSO的96孔板放入37℃ 孵箱内孵育10~20 min,这样有助于 DMSO对紫色结晶物的溶解);
d) 加DMSO后10min内,用酶标仪检测各孔波长490nm的吸光值;
(5)MTT结果分析
6.细胞毒性检测方法的比较

主要参考文献:
1.徐大来, 司远, 田蕾, 等. 免疫效应细胞增殖与细胞毒性功能检测 3 种方法的比较[J]. 南京医科大学学报 (自然科学版), 2021 (3): 355-360.
2.Terrén I, Mikelez I, Odriozola I, et al. Implication of interleukin-12/15/18 and ruxolitinib in the phenotype, proliferation, and polyfunctionality of human cytokine-preactivated natural killer cells. Frontiers in immunology, 2018, 9: 737.
3.Terrén I, Orrantia A, Vitalle J, et al. CFSE dilution to study human T and NK cell proliferation in vitro.Methods in Enzymology. Academic Press, 2020, 631: 239-255.
 文章推荐
文章推荐